CRISPRについては
ゲノム編集の技術と分かっている方や
メカニズム詳細までわかっている方等々、
理解度はさまざまかと思います。
でも
全くわかっていない方が
概要を理解できる情報って
まだまだ少ないのではないでしょうか。
 チクチク
チクチク論文を読んで理解するにも
それなりの時間は必要です



そこそこ詳しく
概要を知りたい…
でも論文を読むのは
面倒って人多いと
思うんです!
そこで本記事では
CRISPR-Casシステムの中で
最も登場が多く基本となる
CRISPR-Cas9について
0から概要がわかる様に解説をしていきます。
専門分野の人にとっては退屈かもしれませんが、
あまり関わりのない人や
学生間で話題になったときに
「あ、コイツ知っているな」
と思ってもらえるくらいの
レベルにはなれるかと思います。



なお当記事は「CRISPR 究極の遺伝子編集技術の発見」ならびに「ゲノム編集の基本原理と応用」「休み時間の分子生物学」を参考に作成しています。



どれも非常に面白いですが、
特に「CRISPR 究極の遺伝子編集技術の発見」はCRISPR発見者の一人、ジェニファー・ダウドナ教授が書いたこともあって、熱がこもっておりオススメです。
CRISPRの歴史と概要、用語解説



最初に歴史と
概要&用語解説です。



歴史と言葉がわからないと
詳しくわからないよね!
CRISPRの歴史
まずは簡単に歴史を紹介します。
CRISPR自体の発見は意外と古いです。
その発見は1986 年。
昭和61年まで遡ります。
さらにCRISPRの最初の発見者は日本人です。
石野 良純博士(九州大学教授)が
29歳で発見しています。
大腸菌の遺伝子解析を行なっていた
石野 良純博士は
大腸菌の遺伝子情報内に
規則正しい塩基配列が繰り返される領域
を発見します。

※最初にCRISPRが見つかった大腸菌
当時はどんな働きをするか
石野博士も見当つかなかったそうですが、
後に解析されCRISPRと
名付けられ現代に至ります。
その後、数多の研究者の手によって
解析が重ねられ、
2012年ついにCRISPRが
飛躍的に活用される時が来ます!
その技術を発表したのは
カリフォルニア大学バークレー校の
ジェニファー・ダウドナ教授と
スウェーデンのウメオ大学の
エマニュエル・シャルパンティエ教授です。



お名前からお気づきの通り
両名ともに女性研究者です。
彼女らはCRISPR-Casシステムの一つである
CRISPR-Cas9(DNA切断酵素)を利用し
簡易かつ高精度で遺伝情報を書き換える
ゲノム編集技術を開発しました。
このCRISPR-Cas9は
ゲノム編集のハードルを大きく下げる技術でした。
ざっくり言うと従来の技術と比べて
安くて簡単、そして汎用性が
非常に高かったのです。
それはもう世界がびっくりするくらい。
すごすぎてCRISPR-Cas9の
2年前に開発された技術が
そっくり取って代わられる衝撃です。



あまりにも使いやすかった(高校生でもできると言われる)ことから瞬く間に世界に広がり遺伝子治療や農作物への応用がすすめられています。
CRISPR-Casってナニ?
間違いなくCRISPRは歴史を変えた技術です。
なんだか凄そうな技術ですよね?
実際、近い将来ノーベル賞を取るのではないか
とずっと言われておりました。
そして!
2020年ノーベル化学賞を
ジェニファー・ダウドナ教授と
エマニュエル・シャルパンティエ教授が
受賞しました。
生理学・医学賞ではなく化学賞の受賞でした。
すごそうな技術だとわかったところで、
実際の内容に入っていきます!
CRISPRの意味
まずは名前からです。
名前を知るのと知らないのでは
どんな技も威力が変わります。



某漫画の斬月のオッサンも
言ってました!
実は当ブログでは
名前の意味を大切にすると言う
裏コンセプトもあります(笑)。
どうでもいいや!!って人は
読み飛ばしてください。
CRISPRはクリスパーと呼びます。
clustered regularly interspaced
short palindromic repeatの
頭文字をとっています。
日本語訳すると
クラスター化され(集まった)
規則的に間隔があいた
短い回文構造の繰り返しです。



は?日本語使えや!回文?



回文ってあれです。上から読んでも下から読んでも同じ文章です。世の中ね。顔かお金かなのよとかです。



分かったけど
そのチョイスどうなん?
ちなみに生物学における回文って
少し変わってまして、
対応する相補的な塩基配列を
逆から読んで回文になっていることを言います。
ちょっとわかりにくいので例をあげますと
【CGGTTTAAACCG】という配列があった場合、その相補的な配列は
【GCCAAATTTGGC】となりますが、←方向に読むと
【CGGTTTAAACCG】となり最初の配列と同じになります。
回文化することでRNAはループ構造を取れます。
RNAが自身とくっ付ける訳です。
よくよくCRISPRに出てくるRNAを観察すると
端が丸まっています。




こんな風に丸まれるのは
回文構造の結果です。
Casの意味
続いてCasです。
Casも同様に遺伝子の領域の名前です。
よく専門書ではCas遺伝子群って言われます。
名前の由来は何かというと
CRISPR-associated
(クリスパー関連)の遺伝子群の
頭文字です。
もともとは
CRISPRを研究していた科学者たちが
CRISPRのすぐ側には
常に別の配列の群があることに気がつき、



これCRISPRに
関連する働き
持っているんじゃね?
ということから
関連遺伝子群という名前になっています。
Cas にはヌクレアーゼやヘリカーゼといった
DNAを分解したり、
切断したりする酵素情報が
記憶されています。
その種類は多岐に渡り、
ここの違いでCRISPR-Casシステムは
さまざまな働きの違いを生みます。
Casから作られるタンパク質は
Cas1やCas9等々、
Cas+番号がふられています。



なおCRISPR−システムは
2015年の段階で2種類6型19亜型に分類されています。
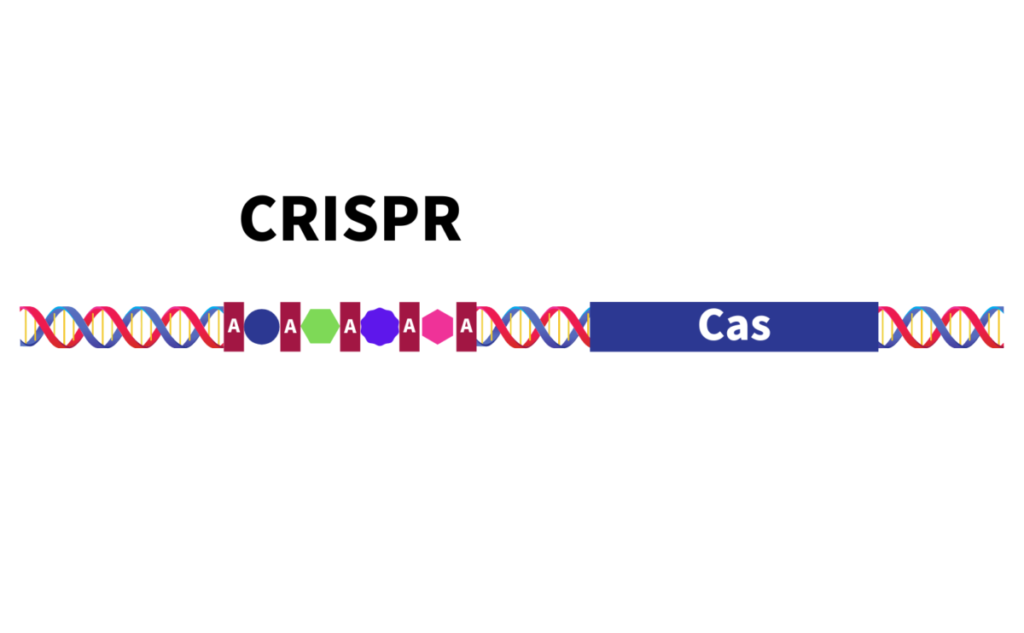

※CRISPR配列に寄り添う様にCas配列は存在しています。
CRISPR-Casシステムの本来の役割
基本用語も分かったところで、
自然界での本来の働きを見てみましょう!
先ほど紹介した通り、
CRISPRは原核生物の遺伝子の
ある領域を示しています。
ここが何をしているかと言うと、
原核生物の免疫記憶スペースです。
CRISPRの回文構造の間には
一定の間隔でスペース
(スペーサー領域と呼びます)がありますが、
このスペーサー領域に原核生物に
感染するウイルスの遺伝(核酸)情報を
記憶することができます。
具体的には
ウイルスの核酸情報の一部を
そっくりそのまま
スペーサー領域に取り込みます。
取り込むことで相手を覚えてしまいます。



余談ですが現在、
CRISPR-Casシステムは
約 2万5千種類の
真正細菌の約50%と
約 340 種類の古細菌の
約90%に見つかっています。
ファージへの感染防御機構
もう少々、メカニズムを紹介します。
ウイルスの仲間には原核生物に寄生し増殖する
ファージと呼ばれるウイルスがいます。
ファージは原核生物内にファージの遺伝情報(DNA、RNA)を送り込んで
原核生物の代謝システムを
のっとって増殖します。
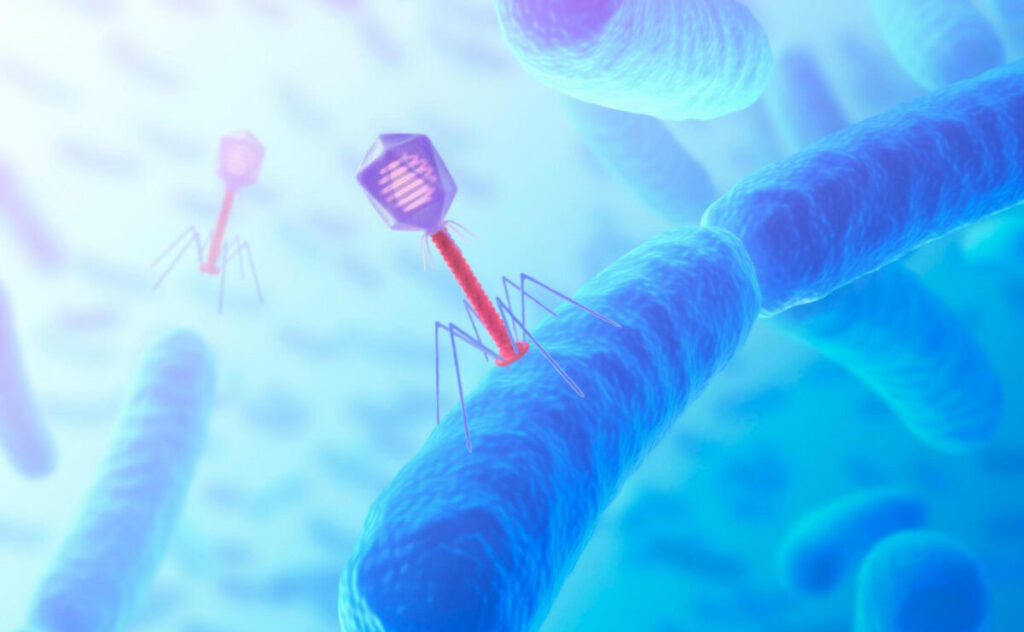

※ファージ:こんな感じで細菌に取り付いて
遺伝情報(DNA,RNA)を送り込みます。
CRISPRはこのファージ感染に
莫大な威力を発揮します。
原核生物のCRISPR-Casシステムは
送り込まれてきたファージゲノム
(DNA、RNA)を破壊できるんです!
- まず原核生物は最初の感染時に侵入してきたウイルスの遺伝情報の一部をCRISPRのスペーサー領域に組み込み記憶します。
- 再度同じDNAをもつウイルスに感染した場合、CRISPRに記憶した情報からウイルスの遺伝情報を識別する物質(crRNA)を作り出します。
- このcrRNAを頼りにウイルスのRNAやDNAを探し当てます。さらにCasから作られる各種タンパク質(核酸分解酵素)を組み合わせることでウイルスのRNAやDNAといった遺伝情報を特定し破壊します。
上記が基本的な
CRISPR-Casシステムのメカニズムです。
取り込んだ情報からRNAを作成し、
それをガイドにCasタンパクを使って
ファージゲノムを破壊します。
単細胞生物である原核生物は
獲得免疫を持たないと考えられていましたが、
それは間違いでした。
原核生物はCRISPR-Casシステムを用いて
高度な獲得免疫システムを有していたのです。



CRISPRは原核生物の
免疫システムなんだね
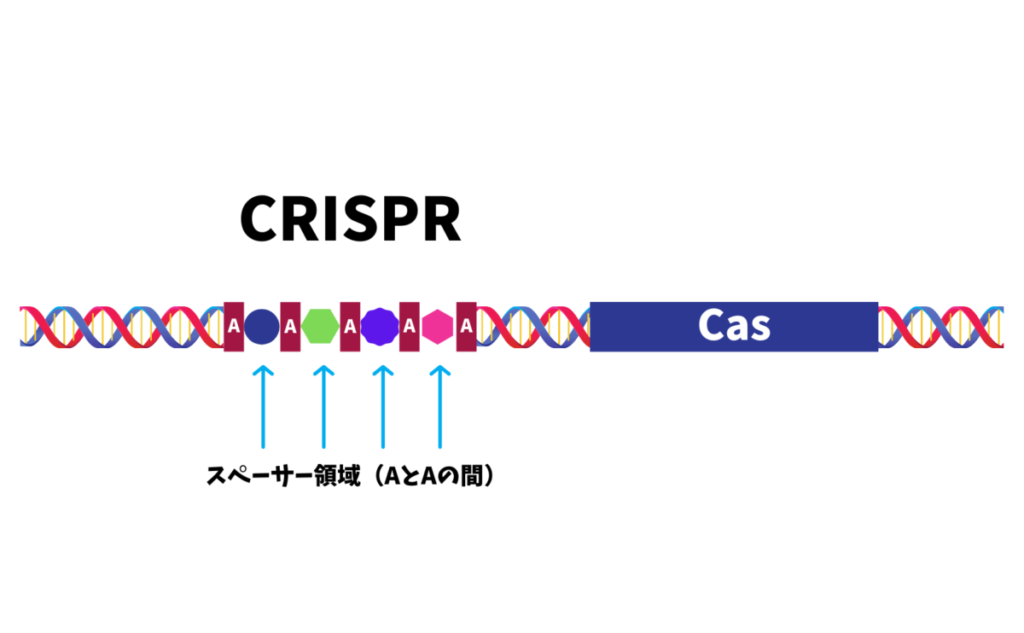

※スペーサー領域には敵性ウイルスの遺伝子情報の一部が
そのまま組み込まれています。
CRISPR-Casシステムを使うことで
原核生物は過去感染したウイルスの
DNAやRNAを破壊し再度感染することを
防いでいます。
補足ですが、
Casの種類は原核生物の種類で
かなりかわります。
生物によって
DNAファージに強い
CRISPR-Casシステムを持っていたり、
RNAに強いシステムを持っていたりします。
※DNAを切断するCas3や9
RNAを切断するCas13等があります。



なお、その類似性から
CRISPR-Casシステムは
原核生物のRNA干渉とも
言われています。


CRISPR-Casシステムの原理:DNA切断メカニズム
続いてどの様にDNAを破壊しているのかを
2種類6型19亜型の中で代表的な
Cas9とCas3を取り上げて紹介します。
CRISPR-Cas3のDNA切断メカニズム
まずはクラス1のCRISPR-Casシステムの
CRISPR-Cas3です。
こちらは大腸菌と緑膿菌から
見つかっているシステムで
複数のCasタンパク質を使うことが特徴です。
第一段階として
10種類または11種類のCasタンパク質と
crRNAがCascadeと言う複合体を形成します。
CRISPR-associated complex for antiviral defense:抗ウイルス防御のためのCRISPR関連複合体:カスケード
Cascadeはファージの遺伝情報から作られた
crRNAを積んでいますので、
それを頼りにファージゲノムを探し当てます。
crRNAはウイルスのDNAと
相補的な構造(鍵穴と鍵の様な構造)に
なっており、探し当てたウイルスの
塩基配列と合致し、標識します。
つまりここがターゲットだよー
って言う目印をつけます。
目印がつくとCas3タンパク質が召喚されます。
召喚されたCas3はボロボロになるまで、
チェーンソーやシュレッダーの様に
標的のDNAを何度も切断します。
それはもう凄まじく
ジェニファーダウドナ博士は
この様に評しています。
ファージゲノムを毎秒300塩基対を超えるスピードで往復してDNAをズタズタにし、長いファージゲノムを屑の山にした。単純なヌクレアーゼが剪定バサミだとすれば、Cas3は驚くほど高速で効率性の高い電動刈り込み機の様だ。
CRISPR 究極の遺伝子編集技術の発見 97Pより引用



DNAぶっ壊す
マシーンってことね



当初はその破壊的能力より遺伝子編集には使えないと思われていました。現にジェニファーダウドナ教授はCas3の研究からCas9の研究に路線変更しています。しかしながら、投入するRNAを調整することで現在は遺伝子編集にも使える様になっています。
CRISPR-Cas9のDNA切断メカニズム
多くのタンパク質とcrRNAを
組み合わせるのがクラス1のCas3でしたが、
クラス2のCRISPR-Cas9が使うタンパク質は
Cas9ひとつです。
CRISPR-Cas9では
crRNAとtracrRNA
(trans-activating crispr RNA)、
Cas9が複合体を形成しDNAを切断します。
tracrRNAはcrRNAと接合し
成熟させる役割を持ちます。
特に実験下においては
エラーを減らし効率化するために
予めcrRNAとtracrRNAを接合させた
sgRNA(single guide RNA)が使われます。
具体的な切断のステップはこんな感じです。
- Cas9がターゲットDNAの
二重螺旋構造をこじ開けます。 - sgRNAが相補的な配列を探索し
DNAと接合し標的します。 - 標識されたDNAの両方の鎖を
Cas9は1箇所(両鎖で2箇所)切断します。 - 切断後Cas9は新たなTGを求めて
別のDNAを探し切断をくし返します。
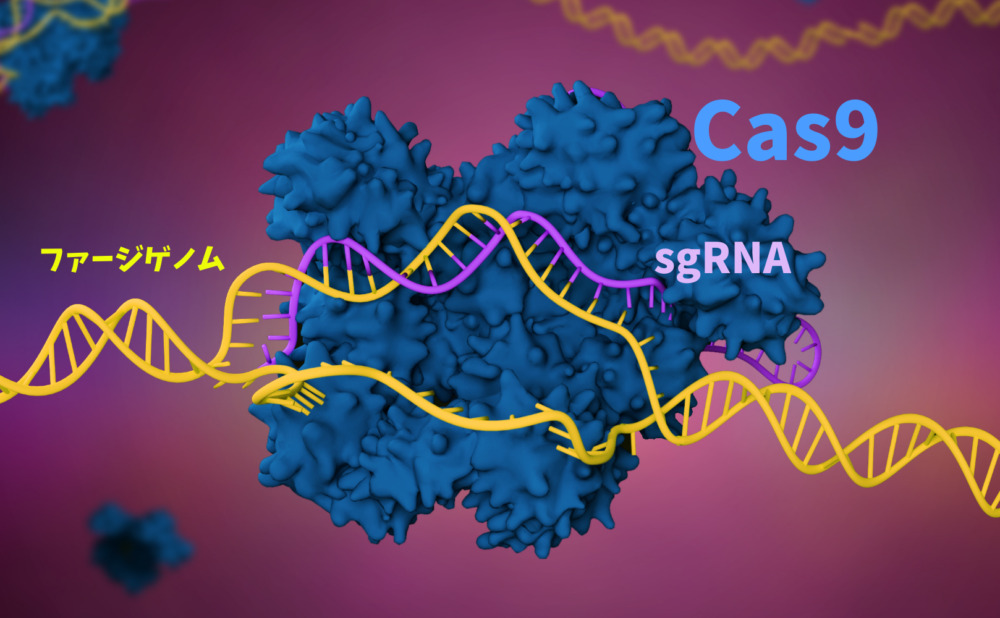




イメージ画像だけではわかりにくいかと思うのでVISUAL SCIENCEの動画を紹介させてもらいます。
丁度50秒くらいから再生してもらうと
Cas9がDNAを切断する方法が確認いただけます。
Cas9タンパクが
グリグリ回ってDNAを切断します。



Cas3と異なり1箇所の切断、タンパク質が1つと非常に簡易であることがCas9の特徴です。
この簡易さが後の応用時の扱いやすさと量産による安価に直結しています。
遺伝子修復とCRISPRを使ったゲノム編集原理
ここまでCRISPR-Casの概要と
DNA切断メカニズムを紹介しました。
ここからはDNAを切断するシステムである
CRISPRがどのようにゲノム編集に
活かされるのか紹介していきます。
あれ?これゲノム編集に応用可能じゃね?
CRISPR-Cas9の作用が
ある程度解き明かされた時、
ジェニファー・ダウドナ教授たちは
あることを考えます。



あれ?これゲノム編集に
応用可能じゃね?
ターゲットがDNAならば
ファージゲノムに拘らず
他の生物のDNAでも
切断できるんじゃないか…
その疑問は的を得ており、
CRISPR-Cas9は全く問題なく
ファージ以外のDNAでも切断します。
CRISPR−Cas9はsgRNAさえ組み換えれば
ほぼ全ての生物のDNAを
切断できるシステムだった訳です。
さらにRNA自体の制作は
これまで遺伝子編集で使われていた
タンパク質よりも遥かに簡単。
(と言うよりもタンパク質作成が高コスト高難易度)
そして作成が面倒なCas9タンパクは
使い回しが可能で
コストが抑えられると
いいことだらけの技術でした。



でも切断するだけの技術が
ゲノム編集に繋がるのは何で?



その疑問は当然だよね。
実は遺伝子修復が
深く関わっているよ。
遺伝子修復
私たちの体は約40兆の細胞で構成されています。
そのため、核内に保存されている
DNAの数も膨大な数になります。
これだけ多いと何らかの理由で
壊れるDNAもすごい数が出てきます。
人体は日光の紫外線や
酸化ストレス等の影響によって、
1秒間に1つDNAが破壊されていると
言われています。
1日あたり86,400の
DNAが壊れている計算です。
教科書によっては、
1日1細胞当たり、1万から100万箇所の頻度でDNAは損傷を受けているとも言われます。
とにかくとんでもない量が壊れています。
当然このままではいけないので、
生き物の細胞にはDNAを
高速で修復するシステムが備わっています。
ヌクレオチド除去修復・塩基除去修復
DNAの2本ある鎖のうち
片方が壊れた場合は
ヌクレオチド除去修復・塩基除去修復
が行われます。
- 破壊された部分が
DNA分解酵素(ヌクレアーゼ)で
除去される。 - もう片方の鎖を参考に
DNA合成酵素(DNAポリメラーゼ)
によってDNAが合成される。 - 切断部位と新しい
DNAを酵素(DNAリガーゼ)が繋ぐ
と言うステップを踏みます。
壊れた塩基が1つの時は塩基除去修復、
ごっそり広範囲の塩基が壊れた時は
ヌクレオチド除去修復が行われます。
どちらも同様に壊れた部分を除去して、
無事な片鎖を鋳型の正常な配列を再構成します。
DNA2本鎖のうち
両方がいっぺんに壊れることって
実は少なくて、
多くの場合は片方が壊れます。
つまりDNA修復の多くは
この方法が取られています。
2本鎖のDNAが1本鎖のRNAより
遺伝情報の保存に向いている理由でもあります。
片方が壊れても片方が残ることで
記録の保存をより確かにしています。
それでも低い確率で
両方同時に破壊される場合もあります。
これはかなりの緊急事態です。
両方破壊された場合は元データが
すぐそばには残っていない訳です。
どうなるのでしょうか。



DNA2本鎖のうち両方が壊れた場合の修復方法は、
参考となるDNAの有無によって2方法に別れます。
非相同末端結合
一つ目がDNA2本鎖のうち両方が壊れ、
近くに参考となるDNAがない場合です。
この場合は壊れた部分を捨てて
取り敢えず繋ぎます。
破壊部分をヌクレアーゼが処理し、
リガーゼが繋ぐだけの簡単な処理が施されます。
ちなみに
非相同末端結合
と言います。
このプロセスは結構適当かつ乱雑な方法です。
壊れた部位を捨てるため
その部分に欠損が生じますし、
全く別の配列が挿入されることもあります。



申し訳程度に
取り敢えず繋ぐ方法ね
相同組み替え修復
二つ目がDNA2本鎖のうち両方が壊れ、
近くに参考となるDNAがある場合です。
前述の方法と比べてこちらの方法は
非常にエレガントです。
この方法は参考となるDNAを
紐解いて活用します。
欠損した部分を参考DNAから探し出し、
さらに参考DNAを鋳型に
正しい配列を作成し修復します。
この方法を
相同組み替え修復
と言います。
口頭だけだと分かりにくいので
動画を見つけてきました。
神動画です。
英語動画ですが、日本語字幕も設定できます。
歯車マークをクリックして
字幕を入れてご確認ください。
ここまで紹介した内容になっています。
CRISPRを使ったゲノム編集
察しのいい方はお気づきかもしれませんが、
CRISPR-Cas9はDNAの両鎖を切断します。
したがって
非相同末端結合
相同組み替えのどちらかが行われます。



そしてこれを応用して
ゲノム編集を行うのです。
ノックアウト
まずはノックアウトです。
Knock OutつまりはKOです。
ボクシングとかで
相手をやっつけた時に使う言葉として
馴染みがありますよね。
ノックアウトは言葉の通り、
遺伝子をKOして正常に働けない様にします。
遺伝情報は精密な暗号なので、
少しの傷で通常は全く働かなくなります。
この方法がCRISPR-Cas9で
最も簡単に行える遺伝子編集です。
非相同末端結合を利用し
遺伝子をノックアウトします。
- KOしたいDNA配列と
相補的なsgRNAを作成。 - sgRNAとCas9を細胞に導入。
- 目的のDNAが切断。
- 非相同末端結合が実施。
- 元どおり綺麗に修復される場合もありますが、即座にCas9が再切断します。
- 最終的に切断部が欠損、または短い間違った配列が挿入されて修復されます。
- 欠損や挿入によりDNAが機能欠損。
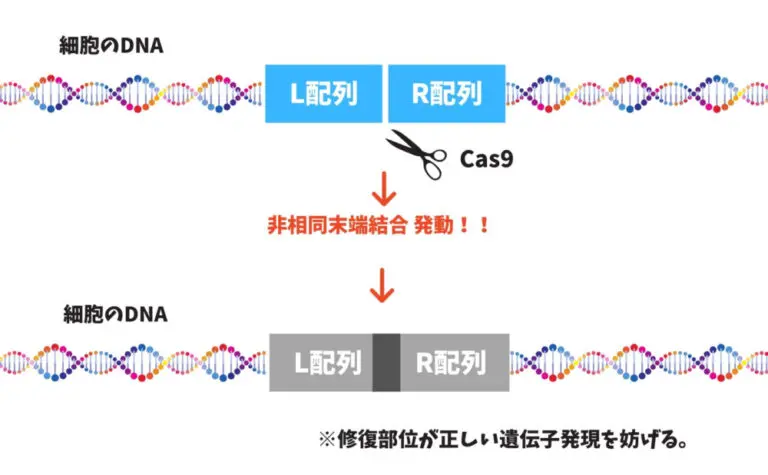




この技術を使えば、目的の遺伝子を不可逆的に止められるので、メラニン色素を生成するDNAをKOしアルビノを作るといったことが簡単にできます。
遺伝子挿入
続いて遺伝子挿入です。
切断した部分に別の遺伝子を挿入して
新たな機能を持たせます。
これには相同組み替えを活用します。
CRISPR-Casによる切断は
切断された後の両側の配列を
正確に予想することが可能です。
(PAM配列:protospacer adjacent motifと言う
決まった配列の3つ隣の塩基を切断するため)
それでは相同組み替えを使った
遺伝子挿入を確認します。
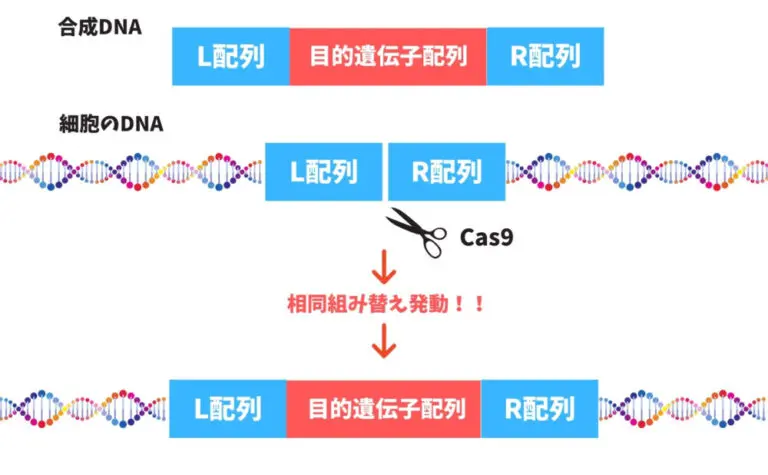
まず便宜上、切断された左側をL配列、
右側をR配列とします。
- 切断する前に『L配列−挿入目的遺伝子−R配列』というDNAを人工的に合成。
- 次にCas9を使ってDNAを切断します。
- 切断されたL配列とR配列の側に『L配列−挿入目的遺伝子−R配列』を添えます。
- 細胞は『L配列−挿入目的遺伝子−R配列』が正しい配列だと勘違いし、相同組み替えを発動します。
- 修復されたR配列とL配列の間には挿入目的遺伝子が入ります。

問題点:オフターゲット効果
かなり神ががっている
CRISPR-Cas9を用いたゲノム編集ですが、
少ないですが当然課題もあります。
その中で最も大きいものが
オフターゲット効果です。
Cas9は目的外の遺伝子を
編集してしまうことが
少なからずあります。
Cas9に使われる
crRNAの長さが20塩基程度と短く、
狙った部位以外で
偶然の一致を起こしてしまう場合に
オフターゲットは起こってしまいます。
また厄介なことに
数塩基の違いならば許容してCas9が発動し
切断してしまうこともわかっています。



少々編集しすぎるのが
CRISPR-Cas9の欠点です。
編集のしすぎが予期せぬ
副作用やがん化を生んでしまうリスクを孕んでいます。
しかしながら科学者はすごいもので、
対応策も現れています。
別々の片方の鎖を切断する様に
改良したCasを使って
2ヵ所同時に切断された時のみ
組み替えが起こるダブルニッキング法
(2ヵ所の塩基配列が同じになる可能性は低い、かつ同時に発動しないと切断されないためオフターゲットが起こりにくい)
逆転の発想でCasの切断能力を失わせ
遺伝子への接着能力のみを持たせた
CRISPR-GNDM
これら等の新しい技術によって、
オフターゲット効果も克服されつつあります。



他にもオフターゲットを減らすための技術が日夜開発されているそうです。
疾患への応用
無限の可能性があると言っても過言ではない
CRISPRテクノロジーですが、
臨床への応用がある程度期待されている
- 筋ジストロフィー
- 鎌状赤血球
- HIV
上記3疾患に関する情報を紹介していきます。
筋ジストロフィー治療

まずは筋ジストロフィーです。
dystrophyは栄養障害という意味です。
dys異常−trophy栄養です。
筋ジストロフィーの直接原因は遺伝子異常です。
その定義は
筋ジストロフィーとは骨格筋の 壊死 ・再生を主病変とする遺伝性筋疾患の総称です。筋ジストロフィーの中には多数の疾患が含まれますが、いずれも筋肉の機能に不可欠なタンパク質の設計図となる遺伝子に 変異 が生じたためにおきる病気
難病情報センターより
という難病です。
筋肉に必要な栄養が
作れないために起こるので、
筋ジストロフィーです。
この病気の治療に
CRISPRを用いたゲノム編集が期待されています。



鍵を握るのは
ミオスタチン欠損症です。
ミオスタチン欠損症
ミオスタチンというタンパク質があります。
このミオスタチンは骨格筋で合成され、
骨格筋の増殖を抑制します。
当然ミオスタチンの情報を
コードした遺伝子があります。
つまりこのミオスタチン遺伝子は
筋繊維の生成にブレーキを掛け
適正な量にコントロールする遺伝子です。



ムキムキの方がよくない???



筋肉はエネルギーを大量に食う組織のなのであり過ぎると大量のエネルギーを確保しなくてはいけなくなるんだよ。
そうすると生存の上で不利になる。それを防ぐための調整機構なんだ。
ミオスタチン遺伝子が欠損している生物は
実はいくつか発見されています。
- ベルジャンブルー種
- ピエモンテ種と言う牛
- テクセル種という羊
などです。
牛羊とどちらも家畜ですが、
愛玩動物の中でも有名なものがあります。
それがウィペットと言う犬です。
ウィペットはドックレースで有名な犬です。
もともとかなり筋肉質な犬ですが、
その品種の中に
ミオスタチン遺伝子2塩基欠損した
ブリーという品種がいます。
ブリー種はそれはもうムキムキです。
ボディビルダーの様な体躯をしています。
多分見た方が早いのでこちらの
URLから検索結果をどうぞ!
ウエンディという名前のブリーウィペットです。
個人的にハムストリングが美しいです。
ブリーは通常種の2倍の筋肉量を誇ります!



襲われたら
100%負けますね!!
ブリーは2塩基の
ミオスタチン遺伝子を欠損しているんですが、
この欠損により筋合成のブレーキが
適切に働かずムキムキになっています。
そしてこの欠損を
筋ジストロフィーに対する治療に
応用する訳です。
筋肉合成のブレーキを司る
ミオスタチン遺伝子を破壊することで
筋肉量を正常に戻そうという訳ですね。
幸い特定の遺伝子のノックアウトは
CRISPRの得意領域です。
具体的にはミオスタチン遺伝子を
破壊する様に調整したCRISPR−Cas9を
何らかの方法(AAVベクター等)で
全身の筋細胞に導入したり、
CRISPR−GMDM(遺伝子を切断しないが接着のみ行って転写を阻害する)を使い
ミオスタチン遺伝子の発現を阻害する
治療薬が検討されています。



何らかの影響で筋肉を合成する指令が少ない病気が筋ジストロフィーですので、ブレーキを取っ払うことで少しでも多くの筋肉を作ろうという狙いです。
反面、病気ではない人の
ミオスタチン遺伝子をノックアウトした場合、
超ムキムキの超人が生まれてしまいます。
技術的には可能です。
(突然変異で生まれた子供が既に存在していますが通常の幼児と比較して40%筋肉量が多いことが確認されています。)
ミオスタチンがノックアウトされた超人が
オリンピックやボディビルディングで
表彰台を席巻するかもしれません。
そういったたくらみは
規制の確立した先進国では行われなくとも
独裁国家では規制されず
行われてしまうかもしれません。



ミオスタチン欠損のデザイナーズベイビーによる超人部隊とかが出来ちゃいます。
CRISPR-Cas9の誰でも、安くできるという利点は新たな驚異を産み始めています。
鎌状赤血球:ドナーのいらない血液疾患治療


CRISPRは特定の遺伝子を選び出して
不活化することが非常に得意です。
人間において
一つの遺伝子変異で引き起こす疾患は
7000にのぼると言われています。
この単一遺伝子変異において
CRISPRは期待されています。



問題の遺伝子を
ぶっ壊せばいい訳ね。
CRISPR-Cas9の得意領域ね。
この単一遺伝子疾患の中で
期待されているものとして
鎌状赤血球症治療があります。
鎌状赤血球は
11番染色体の1塩基がT→Aとなった結果、
翻訳されるアミノ酸が
グルタミン酸からバリンになる為、
赤血球が変異して
酸素運搬能力が低下し貧血になってしまいます。
何だ…貧血かよ!!って思いました?
たしかに鎌状赤血球症はヘテロ型遺伝(
遺伝子を1つだけ持つ)の場合、
日常生活に問題はありません。
しかし遺伝子を2つ持っている
ホモ型の場合は重度の貧血で
亡くなってしまうんです。
さらに激痛も伴います。



子供がなくなる病気です。
何とかしたいですよね。



余談ですがヘテロ型はマラリアに強くなります。そのためマラリア流行域では、この遺伝子が多く存在します。
治療には骨髄移植が有効です。
でも骨髄移植には
ドナー不足や拒絶反応といった
問題がありますよね?
この問題を解決するために
CRISPR−Cas9を使います。
異常を持った患者自身の増血幹細胞を取り出し、
CRISPRを用いて異常部分を編集し
再度患者自身の中に戻すんです。



患者自身の細胞がドナーなので、拒絶反応やドナー不足といった問題を解決できると期待されています。
《最新情報の追記》
2020年12月5日、
NEJMに臨床応用成功の論文が掲載されました。
論文:CRISPR-Cas9 Gene Editing for Sickle Cell Disease and β-Thalassemia
CRISPRで問題となる
オフターゲット効果もなく
1年以上たっても
βサラセミア患者と
鎌状赤血球患者の非輸血性を確認したとのこと…
この技術が拡大すれば、
骨髄移植なく血液疾患の
治療ができる時代が来るかもしれません。



CRISPRTherapeutics、VertexPharmaceuticalsという
CRISPRバイオベンチャーの資金提供を受けている様ですね。
HIV治療への応用

最後にHIVです。
HIVの紹介はいらないかと思います。
免疫を司るヘルパーT細胞に
寄生する厄介なウイルスです。
最終的にT細胞が減っていき
免疫システムが破綻します。
HIVは感染する時に
CCR5というT細胞の表面にある
タンパクを足掛かりにします。
不思議なことに白人には
CCR5遺伝子を欠損している人が1%いまして、
彼らはCCR5タンパクをT細胞表面に持ちません。
CCR5がないことで
何か日常生活に影響があるかというと、
そんなことはなくいたって健康です。
さらにHIVに対する抵抗力を持ってます。
これをもとに科学者は考えました。



HIV感染者の非感染のヘルパーT細胞のCCR5をノックアウトすればHIVに対して抵抗性を得られるんじゃ?
これは本当に行われていて、
サンガモセラピューティクスという
カリフォルニアの会社が
ZFNという遺伝子編集技術で
一定の成果を既に上げています。
さらにCRISPRテクノロジーを使えば
さらに低コストで実施か可能だと考えられます



これは患者自身の白血球を医薬品に改造する方法と言えますね。まさにオーダーメイド医薬品…
その他にも根治的な方法として、
感染した細胞のHIV遺伝子自体を
CRISPR−Cas9で切りとり、
患者の細胞から
完全にHIVを除去する方法も検討されてます。



え?完治じゃん!!!
動物実験ではテンプル大学と
ネブラスカ大学医療センターが
既に成功しています。



感染されたら取り除けないと考えられていたHIVですが、
近い将来取り除ける様になるかもしれませんね。
まとめ
いかがでしょうか。
- CRISPRの概要
- 切断メカニズム
- DNA編集の方法
- 懸念点
- 疾患への応用
主に上記5点について
紹介させていただきました。
恐らくここまで読んでいただいた方は
かなり概要を押さえていただけたのでは
ないでしょうか?
明日から
『あ、こいつ分かってやがる』
と思ってもらえること間違いなしです。



この記事が面白かったら
SNSで拡散してもらえるとすごく嬉しいです
\ 当ブログのCRISPR関連記事はココ /