ドチク子
ドチク子随時追記しているため、時系列に並んでいます。



目的の内容がある場合は目次より飛んでください。
当ブログでは、製薬会社のやらかし記事も掲載しています。関連情報は以下リンクより確認できます!
2020/04/07:15品目の自主回収~直感的に感じた『日医工がやばい!!』~
4/9の業界紙ミクスに以下記事が載りました。
日医工は4月7日、同社が製造する12成分15品目を自主回収(クラスⅡ)すると医療関係者への周知を開始した。
4/9ミクスオンライン
回収の内訳は、
①安定性モニタリングにおいて承認規格に適合しないもの「8成分9製品」、
②出荷時の定量試験で実態と手順に齟齬が生じていたもの「2成分3製品」、
③出荷試験の溶出性で社内規格を下回る製品が出荷されていたもの「1成分1製品」、
④安定性モニタリングにおいて定量試験および純度試験(類縁物質)が承認規格に適合しないもの「1成分2製品」-あった。
自主回収する製品の業績影響は、売上高の1%程度としている。なお、承認規格に適合しなかった理由については、社内調査中としている。
これを見た瞬間にチク子



理由不明だけど馬鹿みたいに多いぞ?



後発品会社は高い製剤技術が売り。
内容次第では非常に大きな信用問題になるんじゃないか?
と感じました。
考え過ぎかもしれませんが、
とりあえず見にくいので表にしてみました。
日医工の回収品15品と理由
| 商品名 | 回収理由 |
|---|---|
| ランソプラゾールカプセル30mg | 溶出試験において実態と手順に齟齬 |
| ランソプラゾールカプセル15mg | 定量試験および溶出試験において実態と手順に齟齬 |
| メキシレチン塩酸塩カプセル50mg | 定量試験において実態と手順に齟齬 |
| プラバスタチン10㎎ | 定量試験および純度試験が承認規格に適合しない |
| プラバスタチン5㎎ | 定量試験および純度試験が承認規格に適合しない |
| オルメサルタンOD錠20mg | 出荷試験の溶出性が社内規格を下回る |
| ベタヒスチンメシル塩酸錠6㎎ | 溶出試験が承認規格に適合しない |
| ニコランジル錠5mg | 定量試験または製剤均一性試験が承認規格に適合しない |
| テプレノン細粒10% | 定量試験が承認規格に適合しない |
| テプレノンカプセル50mg | 定量試験が承認規格に適合しない |
| テオフェリン除錠錠100mg | 溶出試験が承認規格に適合しない |
| セフテラムピボキシル細粒小児用10% | 純度試験が承認規格に適合しない |
| セファクロルカプセル250mg | 純度試験が承認規格に適合しない |
| グリメピリド錠1mg | 溶出試験が承認規格に適合しない |
| ATP腸溶錠20mg | 溶出試験が承認規格に適合しない |



オルメサルタンとかランソプラゾールとか
有名で処方量多い薬が沢山入ってますね。



これは回収&お詫びしなきゃいけない施設が山ほどありそう…
04/26:回収の考察
社内規格不適合は1件。
他は、試験方法そのものが間違っている齟齬。
そして、承認規格に適合しないものが流通したという内容ですね。
複数の試験方法で適合外が見つかっています。
このことからも問題は1つではなく複数発生してそうです。
これらの不適合品が時期をずらして
17年9月26日~20年4月3日まで出荷されていました。
2年半にわたってこれだけの品目に何らかの規格外品が流通していたわけで、
患者さんへの健康被害はないとしても、
信用への影響は非常に大きいんじゃないでしょうか?
先ほども述べた様に後発品会社というのは
高い製剤技術と信頼性が求められます。
今回の件は



3製品は試験方法勝手に変えてやってました。
そして12製品は作られたものが規格外でした!!!
というものです!
これは製剤技術に関する信頼が大きく損なわれる理由として十分ではないでしょうか。
1製品規格外が出た回収!!という話は良くあります。
しかし、今回のケースは規格外だけでなく承認外の試験方法も同時です。
管理体制自体に問題があると疑われても仕方がない内容です。
さらに言うと時期が悪い!!
コロナで緊急事態宣言が出ている中、特約店のMSさんは回収のために医療機関を飛び回らなくてはなりません。



ウイルスの拡散を防がなくてはならない時期にMSさんが医療機関に訪問しなくてはいけない理由を作ってしまったという社会的な責任はあるのではないでしょうか。
04/26:日医工の変化を振り返る


この画像は日医工の投資家向けプレスリリースのページです。(2020/04/26づけ)追加情報含めて回収に関する記事は1つもありません。GW前の04/26になってもプレスリリースすら出さないっていうのは企業姿勢としてどうなのかなとは思います。
既に2週間以上たってますからね。
プレスリリースはしない方針なんでしょうか。ここでも少し信頼性に疑問符がつきますね。
さらに市場の大半を押さえていた薬剤では、絶対的な物量が足りなくなり、競合他社では対応できず出荷調整がかかっています。ATP製剤の出荷調整やらテプレノンの出荷調整やらで業界他社に迷惑かけまくってますね。
なぜ売り時なのに競合他社は出荷調整するの?と思われる方もいるかもしれません。
これは欠品を避けるために行われます。欠品すると今まで非日医工品を選んでいた競合他社にとってのお得意様である医療機関に薬を納入出来なくなり迷惑をかけてしまいます。
既存のお得意様>新規のお客様(日医工のお客様)
となるのは至極当然の流れですよね。当然、日医工を信じて使っていた医療機関は必要な薬が手に入らなくなります。こういったリスクを避けるためにも後発品メーカーは製剤技術に対する信頼性確保が重要なんです。
問題を受けての対応
4/1の人事異動からは今回の件に対する対応がみられます。


4月7日のプレス前に既に組織改編していたんですね。
GMP監査室を新設する様です。
GMPはGood Manufacturing Practiceの頭文字です。
製造管理とか品質管理基準を示した規範となってます。
そこんとこを監査して、管理体制を強化したと見られます。



問題に関してプレスは出さないけれども人事異動で示す…



…多くは語らず背中で示すということ?
05/18:さらに9品目の自主回収
8成分9製品の自主回収が追加で発生しました。
せっかく4/26の追記で少し褒めたのに…背中で語るんだと思っていたのに…計24品目の自主回収になりました。



これは史上最大規模ではないでしょうか。
特約店MSと顧客がブチ切れる絵が浮かぶ…
ミクスオンラインの記事を引用します。
日医工の田村友一社長は5月18日の決算説明会(Web会議形式)で、同社の富山第一工場で製造する8成分9品目33ロットについて「承認書に記載のない工程を実施していた」等の事案が発覚し、当該製品と対象ロットについて自主回収(クラスⅡ)を開始したことを明らかにした。
同社は4月にも同じ工場で12成分15品目が「承認規格等に適合せず」として自主回収を行っていた。田村社長は決算説明会の冒頭で、「多くの製品の回収により患者様、医療機関、卸の方々、製薬企業の皆さまに多大なるご迷惑をおかけしたことを心よりお詫び申し上げます」と謝罪した。
また同社として5つの品質改善への具体策を公表し、取り組む姿勢を表明した。
上記同様に商品名と回収理由を表にしました。
| 商品名 | 回収理由 |
|---|---|
| イフェンプロジル酒石酸塩錠20mg「日医工」 | 承認書にない工程を実施していた。規格には適合。 品質に関する科学的妥当性を示せない |
| メキシレチン塩酸塩カプセル50mg「日医工」 | 出荷試験の書類に欠落、定量値が承認規格に適合しない |
| オロパタジン塩酸塩OD錠5mg「日医工」 | 出荷試験の書類に欠落。規格には適合。 欠落部分での品質の担保が証明できない |
| ゾルピデム酒石酸塩錠10mg「日医工」 | 出荷試験の書類に欠落。規格には適合。 欠落部分での品質の担保が証明できない |
| プラバスタチンナトリウム錠10mg「日医工」 | 出荷試験の書類に欠落。規格には適合。 欠落部分での品質の担保が証明できない |
| オルメサルタンOD錠40mg「日医工」 | 出荷試験の溶出性が社内基準を下回る。承認規格には適合。 承認規格を下回る可能性を否定できない。 |
| オキサトミド錠30mg「日医工」 | 承認書にない工程を実施していた。規格には適合。 品質に関する科学的妥当性を示せない |
| クリノリル錠50 | 承認書にない工程を実施していた。規格には適合。 品質に関する科学的妥当性を示せない |
| クリノリル錠100 | 承認書にない工程を実施していた。規格には適合。 品質に関する科学的妥当性を示せない |
9品目回収の感想
個人的感想ですが、なんとなく化血研のワクチンの承認外製造事件と似ている気がします。
1人の担当者が同じ薬を何年間も作って、効率と品質を求めていった結果、
承認方法から変化してそれを再申請せず、さらにそれがブラックボックス化していったのでしょうか。(個人意見です)



GMP監査室が出来て、残ってたホコリが叩き出されたという好意的見方もできますし、しばし動向を見守ります。
05/26:メサラジン錠の自主回収
今度は東和薬品から受注生産を受けているメサラジン錠の自主回収が発生しました。
業界紙RISFAXの記事を引用して紹介します。
日医工が製造する品目の自主回収が止まらない「異常事態」が続いている。
引用:https://risfax.co.jp/risfax/177846
煽りを受ける格好で東和薬品は26日、日医工の富山第一工場に製造委託している潰瘍性大腸炎・クローン病薬「メサラジン錠500㎎『トーワ』」について、一部ロットの自主回収に着手した。日医工から出荷時の溶出試験データの取り扱いに不適切な点があったとの連絡が入り、承認規格外であることが否定できないためだ。
東和薬品の説明によると、日医工が溶出試験を実施したところ、承認規格外であると判明。その後、あらかじめ定めていた手順書に基づかない方法で処理し、出荷していた。
現在、「原因究明と再発防止を日医工にお願いしている」状況。他に製造委託する「数品目」では「不備は認められないと(日医工から)回答をもらっている」という。
日医工にとって他後発品会社からの受注生産は大きなビジネスでした。
他の会社からも製剤技術を高く評価されていたのでしょう。
もともと製剤技術を評価されていたからこそ出来ていた受注生産ですが、
今回はその部分への信頼も傷つけてしまったでしょうね…
個人的に気になるのは
日医工が溶出試験を実施したところ、承認規格外であると判明。その後、あらかじめ定めていた手順書に基づかない方法で処理し、出荷していた。
ここ!!
いや、出荷すんなよ!



何故出荷対応になるんだ???
データに基づく判断が重要な医薬品製造の現場でこういう判断しちゃうマネージャーや従業員はおかしいでしょう。だめだってわかってるのに出荷しているのは理解不能ですね。医療機関でも日医工品を全て切り替えたという話も聞くようになってきました。
どこまでこの問題は拡大するのでしょうか。
07/13:役員処分の実施
新しく追加でプレスリリースが発行されました。
内容は本件に伴う役員の処分です。
| 役職 | 氏名(敬称略) | 内容 |
|---|---|---|
| 代表取締役社長 | 田村 友一 | 月額報酬 50%(12 ケ月)減俸 |
| 代表取締役副社長 サプライチェーン・BS マネジメント担当 | 吉川 隆弘 | 月額報酬 30%(6 ケ月)減俸 |
| 取締役副社長 CSR・ESG・ビジネス創造担当 | 赤根 賢治 | 月額報酬 30%(6 ケ月)減俸 |
| 取締役専務 利益・資産管理担当 | 稲坂 登 | 月額報酬 30%(6 ケ月)減俸 |
| 上席執行役員 品質管理本部長 | 田村 智昭 | 上席執行役員 品質管理本部長解任、 月額報酬 30%(3 ヶ月)減俸 |
| 上席執行役員 信頼性保証本部長 | 島崎 博 | 額報酬 30%(3 ヶ月)減俸 |
| 上席執行役員 生産本部長 | 高石 正俊 | 額報酬 30%(3 ヶ月)減俸 |
| 執行役員 信頼性保証本部副本部長 総括製造販売責任者 | 坂 孝男 | 執行役員 信頼性保証本部副本部長 総括製造販売責任者の任を解く |
| 顧問 | 浦山 秀好 | 顧問を退任とし、 報酬の一部の自主返納を要請する |
- 社長は50% 6ヶ月の減俸
- 取締役は30%6ヶ月の減俸
- 上席執行委員会は30%3ヶ月の減俸
上記ロジックのもと品質管理本部長と統括製造販売責任者と顧問を解任という感じでしょうか。信頼性保証本部長が解任されていないのに、信頼性保証副本部長が解任されているのは統括製造販売責任者としての責任を問われたと考えると自然です。
統括製造販売責任者は医療機器の品質管理及び製造販売後安全管理を行うものと法第17条第1項にて定められています。簡単にいうと医薬品製造販売業の実務のトップです。顧問は外部監視機能を十二分にこなせなかったということでしょうか。
取締役の解任はないのか…蜥蜴の尻尾きりか?と思っていたところ、途中に取締役 (超品質・安定供給担当) 川岸 浩は、2020 年 7 月 13 日付で取締役を辞任いたしましたと記載がありました。既に品質管理を担当する取締役は辞任していたので、他の解任はないということでしょう。
さらに
代表取締役社長が「コンプライアンス管掌」、および代表取締役副社長が「超品質」の任にあたることとし、経営トップが自ら率先してコンプライアンスへの取り組みの強化、徹底を推進してまいります。
当社製品の自主回収に対する役員等の処分について
また、弊社では、品質に関する根本精神となります『日医工グループの品質方針』についても全面的な見直しを行い、役員及び社員全員の認識を一新して医療用医薬品製造販売者としての社会的責任を果たしてまいります。
という記載からも、会社の根本を見直す姿勢を読み取ることができます。
まとめると日医工からのメッセージとしては
- 品質保証関連役員の刷新
- 品質管理の根本精神『日医工グループの品質方針』の全面的な見直し
- トップによる直接のコンプライアンス管理
上記により品質保証の信頼を取り戻す様、対応を行っていきます。というところでしょう。解任によってできた空席には同日に発行された人事異動についてというプレスリリースにて後任人事が記載されています。



今回を持って責任の追求はすんだと見るべきでしょう。いつまでも追求しても仕方ない内容ですしね。残るは原因の発表だけでしょうか。
07/31:4製品の自主回収
役員の引責をもって幕引きとはなりませんでした。
新たに4製品の自主回収が発生しました。
| 製品名 | 回収理由 |
|---|---|
| リネゾリド点滴静注液600mg「日医工」 | 環境モニタリング試験(浮遊微粒子、付着菌・浮遊菌・落下菌)に不備 |
| ゾレドロン酸点滴静注液4mg/100mLバッグ「日医工」 | 環境モニタリング試験(浮遊微粒子、付着菌・浮遊菌・落下菌)に不備 |
| レボフロキサシン点滴静注バッグ500mg「日医工P」 | 環境モニタリング試験(浮遊微粒子、付着菌・浮遊菌・落下菌)に不備 |
| レバミピド顆粒20%「日医工」 | 安定性試験結果の確認に於いて、試験検体の保管状況等に逸脱があり、 正確な試験結果が得られていない |
しかし今回のうち3製品は巻き込み事故ですね。共和クリティケアのソフトバッグ品が大量に自主回収になっており日医工も上記3製剤は委託していたようです。
ミクスオンラインにも以下記事が掲載されています。(共和クリティケア受託製造品の自主回収問題 高田製薬、日医工などに拡大)
共和クリティケアはソフトバッグの受注専門メーカーみたいですね。
正直、病院薬剤師の先生は対応で大変な思いをされているのではないでしょうか。
かなりのソフトバッグ製品が回収ですから…欠品にならないことを祈りたいですね。



ただレパミピド!!こっちはダメですね。
試験検体の保存方法がそもそも逸脱していて検査できません…ってそれはないでしょう。
まぁこれまで、『それはないでしょう!』の連続なので今更感があるのが悲しいです。



製造工程のみならず、試薬検体の保存にも逸脱があってはこの会社のデータの何を信じればいいのでしょうか。



個人の感想としては信頼性が地に落ちてさらに地下まで掘っていますね。
08/19:原因についての見解
ついに、一定の見解が出てきました。
日刊薬業さんが田村社長に取材を行っています。
問題が発生したことについて田村氏は「量的な拡大を行うために、現場で無理をさせ過ぎたのが背景だと思う」と述べた。
高山工場を最大活用、新たな品質体制構築へ 日医工・田村社長、一斉自主回収「現場に無理させた」
(中略)
キャパシティーを上回る供給を行う体制において品質や製造の管理、試験対応などが十分にできていなかったと説明した。そのような18年までの生産体制で起こった歪みの是正を模索する中、武田テバとの高山工場に関する交渉が始まったことも契機とし、一斉に製造工程の調査を実施。結果、今春の自主回収につながった。田村氏は医療機関や特約店などに「大変ご迷惑をお掛けした」とし、社内においても「特に営業には負担を掛けた。(医療機関などから)お叱りを受ける中で不安やストレスを抱かせたことは間違いない」と振り返った。
拡大路線を走った結果、現れた歪み。それが武田テバとの合併で叩き出されたということでしょうか。
私見ですが、医薬品産業が締め付けられる昨今、無理はどんな会社もしている訳で、
それが不正に繋がったと表すのは違うんじゃないでしょうか。



無理の中で、超えてはいけない一線を守れなかったって事が直接的な問題なはず…生命産業に関わる自覚というものがマネージャー&現場サイドに欠如していたと言うことです。
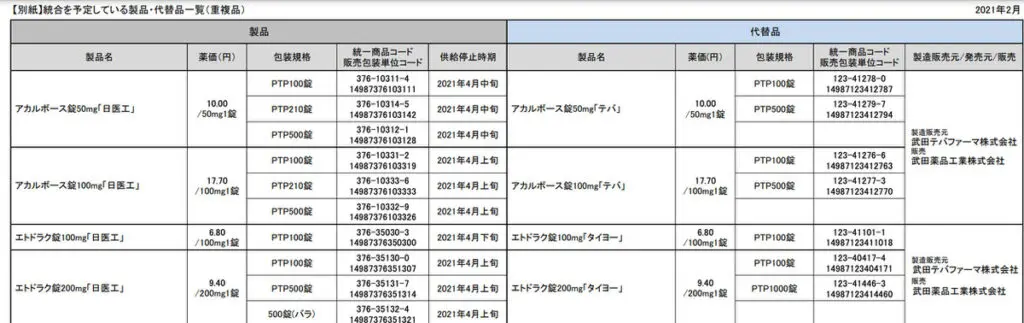
09/08:ブロチゾラムの出荷停止
流石にもぅ終わりかなーと思っていましたが、まだまだ続きますね。



そろそろホントにヤバくない?
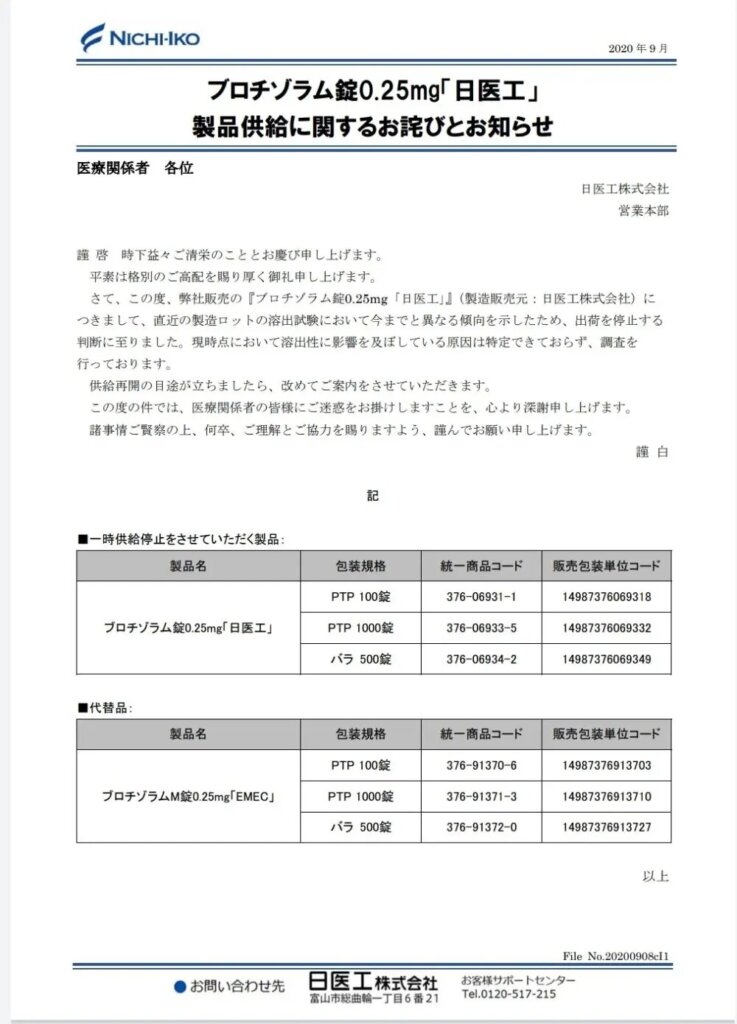

今回は睡眠導入剤レンドルミンの後発品ブロチゾラム!!
睡眠導入剤なので、採用先は多そうですね!
温情で残しておいたのに在庫なくて困りまくる調剤薬局様が目に浮かびます…
4月に始まった当問題も既に6ヶ月…そして5回目の供給問題です。
こんな事言いたくはありませんが「いつまでつづくの??」
「契約医療機関はいつまで欠品に怯えればいいの??」と怒りを感じ始めています。
未だ契約を続けている優しい医療機関の方も欠品リスクに対応する為、
欠品したら本当に困る採用品は見直した方がいいのかもしれませんね。



流石に付き合いきれない医療機関多いんじゃ?
09/16:ジアスターゼ、パンクレアチン、メトホルミン自主回収



え??今月2回目??



ま…まじか。なんも言えねぇ!!
健胃消化剤のジアスターゼでは
長期安定性試験において、一部の製品で乾燥減量※が承認規格に 適合しない結果が得られました。他ロットについても、使用期限内に承認規格外となる可能性が否定 できないことから、当該品の使用期限内の全ロットを自主回収致します。 乾燥減量が承認規格上限値を上回っておりますが、定量値については承認規格内の結果であるため、 製品使用によって重篤な健康被害が発生する可能性はないと考えております。なお、現在までに、 本件に起因すると考えられる重篤な健康被害の報告は受けておりません。
引用:ジアスターゼ「日医工」 自主回収に関するお知らせとお願い(クラスⅡ)
同じく健胃消化剤のパンクレアチン
長期安定性試験において、一部の製品で定量試験 (でんぷん糖化力)が承認規格に適合しない結果が得られました。他ロットについても、使用期限内 に承認規格外となる可能性が否定できないことから、当該品の使用期限内の全ロットを自主回収 致します。 定量値が承認規格下限値を下回り、十分な効果が得られない可能性がありますが、製品使用に よって重篤な健康被害が発生する可能性はないと考えております。なお、現在までに、本件に起因 すると考えられる重篤な健康被害の報告は受けておりません。
両方とも長期安定性試験の結果ですね。
コレ見たとき怖いな。。。と正直思いました。
これまでは作り方変えていたり、規格外品出品したり、そのせいで溶出試験結果が規格外だったりという結果でした。
でも不思議と長期安定性試験の結果ってなかったんですよね。
多分試験を行うタイミングじゃないんだろうな…そのうち出てくるでしょう。と思っていました!!
そしてやっぱり出てきました。
恐らくこれまで発表された回収は氷山の一角で、
長期保存に影響を与える程度の軽微な製造変更が数多く眠っていて、
長期安定性試験で明らかになったのではないのかなと、
私見では考えています。
この考え方が正しければ、
これから長期安定性試験逸脱品が続出する可能性もあります。



正直考えたくありません。
メトホルミンの回収は?
メトホルミンも発がん性物質のNDMA混入です。
当然これも問題ではあるのですが、少し毛色は違います。
そもそもNDMAの規制はつい最近の出来事でして、
メトホルミンも確認したら数社出てきたのでいっせいチェックが国から入っています。
詳細は過去記事:NDMAまとめに詳しく記載していますのでご参照ください。



長期安定性がやばいとなると全品目疑われてくるよね…



社長!!早くなんとかして!!!
11/09:新たに6成分7品目の自主回収
止める気あるんでしょうか…プラバスタチンに関しては3回目の自主回収です。



…擁護できなくなって来たぞ?
- タムスロシン塩酸塩カプセル0.2㎎:書類に欠落があり、出荷時の品質に問題があると考えられた。
- ニチコデ配合散分包:安定性 モニタリングにおいて、定量試験が承認規格に適合しない結果が得られた。
- バラシクロビル顆粒50%:定量試験および溶出性試験が承認規格に適合しない結果が得られた。
- プラバスタチン10㎎:溶出性試験が承認規格に適合しない結果が得られた。
- ホスホマイシンカルシウムカプセル500:承認書に記載のない工程を実施していることが判明
- ランソプラゾールカプセル15㎎:出荷時の定量試験及び溶出性試験において、実態と手順に齟齬
- ランソプラゾールカプセル30㎎:出荷時の定量試験及び溶出性試験において、実態と手順に齟齬
- 日医工自主回収ページ資料より転載
全部ダメダメなんですけど、
特にダメだろ!!と思ったのはタムスロシンとプラバスタチンですね。
製造期間にご注目ください
タムスロシン該当ロット製造期間は2019年12月〜2020年10月29日
プラバスタチン該当ロット製造期間は2020年3月1 日~2020年5月20日です。
みなさん、この事件が長期になってお忘れでしょうが、
当事件が最初に起こったのは2020年4月7日です。
タムスロシンに関しては事件後半年、書類に欠落状態が続いた!
プラバスタチンに関しては4月7日にも自主回収があったにもかかわらず、溶出性試験に適合しない製品を作り出荷していた!!という状態です。
事件後何してたんだ????
と言われても仕方がない結果です。
事件ありました!改善しました!ならOKでしたが、実際は、事件ありました!!改善しました!!やっぱダメでした!!しかも1製品は最初にダメだったやつです。またダメでした!!が現状です。多分次もダメでしょう。



もはや何を信じればいいのでしょう…
地に落ちた信頼がドリルで地下を掘っていく様です。



本当、良く掘れるドリルだなぁ( *`ω´)
12/04 :アンブロキソール塩酸塩徐放カプセル45mg一時供給停止



さぁみなさん!毎月恒例、日医工の製品問題の時間です。



今回は自主回収ではなくて供給停止だけど、問題の本質は同じっぽいので追記します。





溶出規格不適合で2020年12月から21年3月まで共有停止です。



罪深いんだけど、これまでみたいに流通させて自主回収でない分、まだいいのか?



ちょっと感覚おかしくなって来てますね…
12/09:さらに4製品の自主回収発生



今月2回目ですね。
今回回収があるのは以下4製品です。
- テオフェリン徐放ドライシロップ小児用20%
- リシノプリル錠10㎎
- ランソプラゾールOD錠30㎎
- プラバスタチンナトリウム錠10㎎
テオフェリンは2回目の回収(前回は錠剤ですが)、
ランソプラゾールは3回目、プラバスタチンは4回目の自主回収です。



事件発覚後に作った製品すら自主回収するのホントやめてほしい…
ついに来た!長期安定性試験不適合品
今回の原因は以下の通りです。
- テオフェリン:長期安定性試験で定量試験が長期安定性試験に適合しない
- リシノプリル:参考品の溶出性試験不適合
- ランソプラゾール:参考品(24&36か月)にて純度試験不適合
- プラバスタチン:溶出性試験不適合
9/16の自主回収の段階で
恐らくこれまで発表された回収は氷山の一角で、長期保存に影響を与える程度の軽微な製造変更が数多く眠っていて、長期安定性試験で明らかになったのではないのかなと、私見では考えています。この考え方が正しければ、これから長期安定性試験逸脱品が続出する可能性もあります。
と述べましたが、この不安が的中してきたようです。



まだまだ出てくると考えるべきだよね。
2021/01/13:過去最大の38品目の自主回収



年始早々ぶち上げてくれました!過去最大の38品目の自主回収です。



あまりに品目が多いので簡単に一覧表にいたしました。まずはご確認ください。
| 製品名 | 回収理由 | 期間 (ロットが複数ある場合は最古~最新を記載) | 備考 |
|---|---|---|---|
| アムロジピン錠10㎎「日医工」 | 出荷試験の結果を再確認したところ、 再試験で適合とされたものについて、再試験の実施に至る検証が行われていない。 | 2018/11/19-2018/12/25 | 含量が規格を下回り、有効性の低下が懸念される |
| アムロジピンOD錠2.5㎎「日医工」 | 出荷試験の結果を再確認したところ、 再試験で適合とされたものについて、再試験の実施に至る検証が行われていない。 | 2019/12/2-2020/2/6 | 含量が規格を上回る |
| アンブロキソール塩酸塩錠「日医工」 | 出荷試験の結果を再確認したところ、 再試験で適合とされたものについて、再試験の実施に至る検証が行われていない。 | 2016/12/20-2017/07/05 | 含量が規格を下回り、有効性の低下が懸念される |
| エチゾラム錠1㎎「日医工」 | 出荷試験の結果を再確認したところ、 再試験で適合とされたものについて、再試験の実施に至る検証が行われていない。 | 2018/11/14-2020/12/07 | 効果発現が遅延する可能性あり |
| エバスチンOD錠10㎎「日医工」 | ・純度試験に適合しない結果が得られたロット ・使用期限内に不適合になる可能性があるロット | 2019/02/14-2021/01/12 | 規格内 |
| オルメサルタンOD錠20㎎「日医工」 | ・参考品において溶出性試験承認規格不適合 ・出荷試験の溶出性試験にて社内規格を下回る | 2019/03/27-2020/04/21 | 効果発現が遅延する可能性あり |
| オロパタジン塩酸塩OD錠2.5㎎「日医工」 | 書類に欠落 | 2020/02/25-2020/04/08 | 規格内 |
| オロパタジン塩酸塩OD錠5㎎「日医工」 | 書類に欠落 | 2019/05/20-2020/04/07 | 規格内 |
| カリジノゲナーゼカプセル25単位「日医工」 | 承認書と異なる試験方法を実施 | 2018/11/16-2021/01/05 | 規格内 |
| カリジノゲナーゼ錠25単位「日医工」 | 承認書と異なる試験方法を実施 | 2017/08/25-2021/01/05 | 規格内 |
| カリジノゲナーゼ錠50単位「日医工」 | 承認書と異なる試験方法を実施 | 2017/09/19-2020/04/13 | 規格内 |
| カンデサルタン錠8㎎「日医工」 | 出荷試験の結果を再確認したところ、 再試験で適合とされたものについて、再試験の実施に至る検証が行われていない。 | 2017/08/28-2020/09/03 | 効果発現が遅延する可能性あり |
| グリメピリドOD錠1㎎「日医工」 | 出荷試験の結果を再確認したところ、 再試験で適合とされたものについて、再試験の実施に至る検証が行われていない。 | 2018/11/09-2019/09/06 | 含量が規格を下回り、有効性の低下が懸念される |
| ジピリダモール錠25mg「日医工」 | 原薬において、製造業の許可を有しておらず承認書に記載されていない保管施設にて保管・表示 | 2019/12/06-2021/01/05 | 規格内 |
| シメチジン錠200㎎「日医工」 | 原薬において、製造業の許可を有しておらず承認書に記載されていない保管施設にて保管・表示 | 2020/05/07-2021/01/05 | 規格内 |
| セチリジン塩酸塩ドライシロップ1.25%「日医工」 | 書類に欠落 | 2018/11/02-2020/04/02 | 規格内 |
| テモカプリル塩酸塩錠2㎎「日医工」 | 安定性モニタリング及び参考品において、溶出試験承認規格不適合 | 2018/05/21-2019/02/05 | 効果発現が遅延する可能性あり |
| ドキサゾシン錠2㎎「日医工」 | 書類に欠落 | 2018/05/09-2018/09/03 | 規格内 |
| ドネペジル塩酸塩細粒0.5%「日医工」 | 定量試験が承認規格に適合しない | 2018/12/03-2019/03/26 | 定量値が承認規格下限を下回り十分な効果が得られない可能性あり |
| トリアゾラム錠0.125㎎「日医工」 | 出荷試験の結果を再確認したところ、 再試験で適合とされたものについて、再試験の実施に至る検証が行われていない。 | 2018/07/19-2018/10/29 | 含量が規格を下回り、有効性の低下が懸念される |
| トリメブチンマレイン酸塩錠100㎎「日医工」 | 原薬において、製造業の許可を有しておらず承認書に記載されていない保管施設にて保管・表示 | 2018/12/17-2020/12/08 | 規格内 |
| バルサルタン錠40㎎「日医工」 | 出荷試験の結果を再確認したところ、 再試験で適合とされたものについて、再試験の実施に至る検証が行われていない。 | 2018/08/03-2018/12/12 | 含量が規格を上回る |
| ピタバスタチンカルシウム錠4㎎「日医工」 | 出荷試験の結果を再確認したところ、 再試験で適合とされたものについて、再試験の実施に至る検証が行われていない。 | 2019/06/11-2019/08/23 | 規格内 |
| ピタバスタチンカルシウムOD錠1㎎「日医工」 | 書類に欠落 | 2018/05/15-2018/06/20 | 規格内 |
| プラバスタチンナトリウム錠5㎎「NikP」 | 書類に欠落 | 2020/03/03-2020/10/21 | 規格内 |
| プラバスタチンナトリウム錠10㎎「NikP」 | ・参考品において溶出試験が承認規格不適合 ・定量試験が使用期限内に不適合になる可能性がある | 2019/02/01-2020/05/19 | 効果発現が遅延する可能性あり |
| プランルカスト錠112.5㎎「日医工」 | 出荷試験の結果を再確認したところ、 再試験で適合とされたものについて、再試験の実施に至る検証が手順に従って行われていない。 | 2019/03/18-2019/08/01 | 効果発現が遅延する可能性あり |
| ブロチゾラム錠0.25㎎「日医工」 | ・参考品において溶出試験が承認規格不適合 ・書類に欠落 | 2019/01/24-2020/06/08 | 効果発現が遅延する可能性あり |
| プロピベリン塩酸塩錠20㎎「日医工」 | 出荷試験の結果を再確認したところ、 再試験で適合とされたものについて、再試験の実施に至る検証が行われていない。 | 2020/04/24-2020/09/01 | 含量が規格を上回る |
| べポタスチンベシル塩酸塩錠20㎎「日医工」 | 出荷試験の結果を再確認したところ、 再試験で適合とされたものについて、再試験の実施に至る検証が行われていない。 | 2019/05/22-2019/08/29 | 効果発現が遅延する可能性あり |
| ペングット錠250㎎ | 書類に欠落 | 2019/05/14-2019/06/17 | 規格内 |
| ベンコール配合錠 | 安定性試験(18か月)において崩壊性試験のpH6.8が承認規格に適合しない | 2018/07/17-2019/01/25 | 規格内 |
| メサラジン錠500㎎「日医工」 | 書類に欠落 | 2019/05/21-2019/07/17 | 規格内 |
| モンテルカスト錠10㎎「日医工」 | 出荷試験の結果を再確認したところ、 再試験で適合とされたものについて、再試験の実施に至る検証が行われていない。 | 2018/07/13-2018/10/09 | 含量が規格を下回り、有効性の低下が懸念される |
| ランソプラゾールカプセル15㎎「日医工」 | 出荷試験の結果を再確認したところ、 再試験で適合とされたものについて、再試験の実施に至る検証が行われていない。 | 2019/05/21-2020/04/16 | 含量が規格を下回り、有効性の低下が懸念される |
| ランソプラゾールOD錠15㎎「日医工」 | ・参考品において溶出試験が承認規格不適合 ・純度試験または定量試験において再試験で適合とされたものについて、再試験の実施に至る検証が行われていない。 | 2018/11/06-2021/01/06 | 効果発現が遅延する可能性あり |
| ロフラゼプ酸エチル錠1㎎「日医工」 | ・社内規格を下回る製品が出荷 ・出荷試験の結果を再確認したところ、 再試験で適合とされたものについて、再試験の実施に至る検証が行われていない。 | 2018/12/12-2018/12/27 | 含量が規格を下回り、有効性の低下が懸念される |
| ロフラゼプ酸エチル錠2㎎「日医工」 | ・社内規格を下回る製品が出荷 ・出荷試験の結果を再確認したところ、 再試験で適合とされたものについて、再試験の実施に至る検証が行われていない。 | 2019/07/22-2019/09/03 | 含量が規格を下回り、有効性の低下が懸念される |
1/13回収品目一覧(日医工HP:自主回収にかんする重要なおしらせより作図)



対象ロットはあまりに多いので日医工HPをご確認ください!
回収理由の集計
今回はより分かりやすくするために回収理由を集計してみました。



めちゃくちゃ理由多いですね…


最も多かった回収理由は『再試験の実施に至る検証がされていない』です。
ダブっているものもありますが単体の理由だけでも13件あります。
次点が書類の不備です。
今回これを書いていて本当に驚いたのですが、
この二つに共通することって
「人為的&凡ミス」なんです。
参考品で溶出試験が規格外等に関しては保存状態や各種影響を受ける要因が考えられえますが、
トップ2つは明らかな人為的ミスです!!
- 再試験の実施に至る検証がされていない→検証やれよ!
- 書類の不備→管理職ちゃんとチェックしろよ!
これだけです。
これが理由のトップになる点が日医工の体質の問題点ではないでしょうか?



あと『製造業の許可を有していない施設で原薬保管』とかも3製品理由に上がっていますが、これも人為的&凡ミスですよね…



人手…足りないのかなぁ
さらにこの問題は2020/04/07から始まっていますが、今回、回収される製品の中で、2020/04/07以降も作り続けていた製品が16製品あります。
有効性安全性への影響は?


試験逸脱は溶出試験が多かったためか、問題のある製品の中では効果発現遅延が9製品あります。今回、回収される38製品のうち21製品は有効性・安全性に何らかの懸念がある製品ですので消費者への説明等、市場に与える影響が大きいかもしれません。



医師、薬剤師の先生には多大な労力がかかる気がします…



地獄ね…でも一応今回で最後って社長は言っているみたい。



そんなフラグ立てて大丈夫かな…
01/27:4製品の自主回収
あらたな自主回収が発生しました。今回は下記4製品です。



フラグ回収!!!
最後って言ってたじゃない!!



気持ちはわかる。でも今回は小林化工からの巻き込み事故みたい。
理由は以下の通りです。
他社へ製造委託しております弊社販売の『アトルバスタチン錠10mg「EE」』(製造販売元:エルメッド
株式会社)につきまして、参考品の定量試験において、承認規格に適合しない結果が得られたため、
当該ロットを自主回収致します。
他社へ製造委託しております弊社販売の『アマルエット○R配合錠2番「EE」』(製造販売元:エルメッド
株式会社)につきまして、安定性モニタリングの純度試験(類縁物質)、又は溶出性試験において、承認規格に適合しないロットが確認されました。当該ロット以外のロットについても使用期限内に承認規格外となる可能性が否定できないことから、使用期限内の全ロットを自主回収致します。引用:アマルエット○R配合錠2番「EE」自主回収に関するお知らせとお願い(クラスⅡ)
※なおアマルエットは2番、3番、4番同一の理由です。
“他社へ製造委託しております”というところがポイントでして、この他社が小林化工です。
睡眠薬混入事件を起こした小林化工が当4製品を製造し、エルメッドエーザイが販売。
小林化工が問題を起こして調査したところ違反が判明した形です。
直接の原因は小林化工です。



なお小林化工は同日に21品目の回収を行っています。
メサラジン供給停止から見る日医工の変化



あとポジティブな内容も同日に起こっています。
これ個人的にはかなり好意的に見ています。
同日にメサラジン錠250mg/500mg「日医工」製品供給に関するお知らせも出ているのですが、
直近のロットにおいて、規格に適合した結果が得られているものの、含量のバラつきが製品へ影響を
与える可能性が示唆され、改善が必要と考えられたため、一時供給停止
というものでパッと見だと良くない内容に見えるんですが、よくよく考えると「非常に早い段階で製品への悪影響を察知し問題解決に取り組んでいる」ってことなんです。
これまでならば、見逃して出荷→発覚→回収という流れでしたが、それを未然に防いでいます。
間違いなく品質コントロールレベルがアップしたのだろうと好意的に受け止めています。



社長が言ったとおり、本当に一連の自主回収は終わったのかもしれない!!
02/09:レトロゾール錠 2.5mg「テバ」自主回収
今回の自主回収も巻き込み事故ですね。
謹啓 時下ますますご清栄のこととお慶び申し上げます。平素は格別のご高配を賜り厚く御礼申し上げます。
さて、かねてよりご愛顧いただいておりますアロマターゼ阻害剤/閉経後乳癌治療剤『レトロゾール錠 2.5mg「テ バ」』につきまして、製剤製造所が製造販売承認書に記載のない賦形剤製造所のものを使用し製造したため、使用 期限内のロットすべてを自主回収することとしました。
なお、賦形剤の製造所が異なるのみで、賦形剤の品質は承認 書記載のものと同等であり、製品品質も出荷試験に適合しております。加えて、これまでに本件に関連した健康被害 の報告はありません。
引用:アロマターゼ阻害剤/閉経後乳癌治療剤 『レトロゾール錠 2.5mg「テバ」』 自主回収(クラス II)に関するお知らせ



日医工は呪われているんでしょうか?
本体の体制浄化して、自主回収おわらせて、武田テバをやっと取り込んだと思ったら、
その武田テバからクラス2の自主回収…



見えない力が日医工を追い込んでいる…
02/25:供給停止とブランド統合
同日に2種類の対応がなされました。
10製品の供給停止
まずは供給停止品目です。
供給停止の理由は基本的に全て同じです。
この度、弊社販売の『アムロジピンOD錠10mg「日医工」』(製造販売元:日医工株式会社)につきまして、 製造遅延のため、一時供給を停止させて頂きますので、下記の通りご案内申し上げます。
大変ご面倒をお掛け 致しますが、同一有効成分の下記代替品への切替にご協力をお願い申し上げます。
停止期間につきましては、2021 年 5 月中旬ごろまでを想定しておりますが、供給再開の目途などの詳細が 判明次第、改めてご案内させて頂きます。
要点は下記3点ですね
- 製造遅延により供給停止
- 代替品に切り替え依頼
- 5月まで2ヶ月以上欠品
プレスリリースをみた時の感想としては…
雑か!
これに尽きます。
欠品してユーザーに迷惑かけるなら製造遅延の原因までかけよ!!って話です。
何より今回迷惑をかけるユーザーは御社にとっての天使ですよ??
コレだけ長期にわたって自主回収しているにもかかわらず口座残している
日医工LOVEな天使!!
その相手に説明がコレだけは少なくありません?日医工さん??
そして製造遅延は結果であって原因ではないですからね?報告には結果と原因はセットだろ!原因わからないなら不明って明記して調査中ですって書くのが普通の報告だろ??『製造遅延ですかーわかりました〜大変ですねー』ってユーザーなんてほぼいないぞ?100%『なんで遅延したの?』って思いますからね普通は!!
この文章は営業を全くやったことがない奴が作って営業を全くやったことのない奴が承認したとしか思えない…
ユーザーを馬鹿にした文章ですね。この一連の自主回収の中で一番怒っているかもしれません。



メンタルを酷くかき乱されたため、文体の乱れをご容赦ください。
9成分19製品ブランド統合
同日にブランド統合も行っています。
合併した武田テバ社でも作っていた同成分薬を統合します。
要はダブったんで一つにしますよーって話です。
まぁダブった製品を統合すること自体は全く問題ないと思うのですが、
なぜか日医工の名前を消して武田の名前を残すんですよね!!
気持ちはわかる…失墜したブランドの日医工の名前ではなく日本の王者武田の名前を冠して売り上げを維持したいのはわかる!
でもさ…吸収したから本社日医工ですよね?名前にプライドはないのか!?
それともプライドなんてボロボロで残っていないのか?



違和感の残るブランド統合ね!
業務停止命令をめぐり情報が錯綜
2/25には他にももう一つ事件がありまして、報道各社が業務停止命令を報道。
そして日医工が否定するという珍事が起きています。
日医工が医薬品を相次いで自主回収している問題で、富山県は医薬品医療機器法に基づき、業務停止命令を出すことを検討している。
25日、関係者への取材で分かった。処分は3月中になる見通しで、期間は1カ月前後とみられる。健康被害は確認されていないが、回収する品目数が多く、生産管理体制に問題があったと判断したようだ。
業務停止命令は、処分の中では2番目に重い。引用:日医工に業務停止命令検討 自主回収相次ぎ、1カ月前後
本日、一部の業界紙において、富山県が当社に対して業務停止命令を出す方向で調整に 入ったとの報道がありましたが、当社が発表したものではございません。
また、富山県より現在、業務停止命令は受けておりません。
引き続き、ジェネリック医薬品の信頼回復に向けた企業努力を継続し、安心と信頼への 約束≪日医工グループ品質方針≫に従って、全役員・全従業員の意識改革に努め、患者様 に寄り添うグローバル総合ジェネリック医薬品メーカーとして安心と信頼をお届けするた めに取り組んでまいります。
以 上
よくよく見ると
- 報道は『業務停止を検討している』
- 日医工は『現在、業務停止命令は受けておりません』
なので、矛盾はしてはいないんですよね。
捉え方変えると双方矛盾していない=既定路線と見ていいんじゃないでしょうか。



3/1くらいに正式に富山県から発表されるのではないでしょうか?
にしても検討ってしっかり書いてあるんだから日医工のプレスリリースいる?って思いました。
どのみち業務停止命令受けるのならば返って現場を混乱させるだけな気がします。まぁ私見ですが…
それよりも日医工が業務停止命令を受けるとどれだけの品目が出荷調整になるのだろうか?
現場にどれだけ口座が残っているかわかりませんが、場合によっては卸MSさんが阿鼻叫喚する未来が見えます。



実際2月末のMSさんは殺伐としていたそうよ!
03/03:業務停止命令、役員処分&調査報告書が発表
ついに業務停止命令が出てしまいました。
対象は富山第一工場のみですので全体ではないことは幸いではあります。
期間は2021年3月5日(金)から 2021年4月5日(月)までの32日間です。
そして同日に処分も発表されています。
内容は以下の通りです。
ちなみに2回目の役員処分です、まぁ正直長らく現場の混乱を見てきた身としては
『で?』って感じではあります。
なお処分の内容と考察に関しては膨大になり、本記事に記載すると時系列で出来事を確認することが困難になるため別記事にて紹介させていただきました。以下記事をご参照ください。


03/10:4成分8製品供給停止&29製品41規格販売中止
業務停止命令に伴い供給停止製品が追加されました。
…地獄セカンドシーズンのはじまりでしょうか?
4成分8製品出荷停止
製品ごとに停止時期は異なりますが、3月上旬から4月下旬にかけて順次出荷停止となっています。
5月中旬よりの出荷再開予定となっています。
| トフィソパム錠50mg「日医工」 | 供給停止 | |
| ナテグリニド錠30mg「日医工」 | ||
| ナテグリニド錠90mg「日医工」 | ||
| ピタバスタチンカルシウム錠1mg「日医工」 | ||
| ピタバスタチンカルシウム錠2mg「日医工」 | ||
| ピタバスタチンカルシウムOD錠1mg「日医工」 | ||
| ピタバスタチンカルシウムOD錠2mg「日医工」 | ||
| ベンズブロマロン錠25mg「日医工」 |
29製品41規格販売中止
同時に販売中止品目もかなりの品目が上がっています。
こちらは在庫消尽をもって販売中止です。
詳細はこちらをご確認ください。
よくよく読むとコチラは残る規格もある様なので規格整理ですね。
140錠包装を削除して100錠包装に統一
500や700といった大規格で出荷量の少ないものを統一と行った感じでしょうか?
工場のリソースを適正化するための対応かな?と予想できます。
ただ140錠包装ってそれなりに人気あるし、対応迫られる医療機関は多そうですね。
04/08:新たに2製品の回収
(え?終わったんじゃないの?)
非常に
残念です。
がっかりしました。
国の監査まで入って完全に新たな門出を祝おうと思っていたのですが、
新たな門出(4/6)の2日後に自主回収ですか!!
正直絶望しすぎて記事に追記するまで数日を要しました!!



いやいや田村友一社長!そりゃあないよ!記者会見でこれが最後!!って豪語していたじゃない!?
今回は抗ヒスタミン薬のアレロックとザイザルの後発品ですね。
- オロパタジン:長期安定性試験12カ月及び18カ月において、溶出性試験が承認規格に適合しない結果が得られた
- レボセチリジン:長期安定性試験3カ月及び加速安定性試験1カ月において、溶出性試験が承認規格に適合しない結果が得られた



両方とも原因は長期安定性試験の溶出性試験不適合です…あれ?



長期安定性に関する懸念は都度話してきたよねー
ちなみに日医工、業務停止命令の解説【結局何が原因だったの?】でこんな風にコメントしていました!
恐らくこれまで発表された回収は氷山の一角で、長期保存に影響を与える程度の軽微な製造変更が数多く眠っていて、長期安定性試験で明らかになったのではないのかなと、私見では考えています。
この考え方が正しければ、これから長期安定性試験逸脱品が続出する可能性もあります。
引用:日医工の自主回収のまとめと理由一覧表【自主回収が止まらない】しかしこの後、長期安定性試験逸脱はほとんど起こりませんでした。私の考えは外れたわけです。
『おかしいなぁ…考えすぎだったか…外れちゃった。てペぺろ。逸脱ないことはいいことだしね』と思っていたんですが、違いました!!
そもそもやっていなかったんだから逸脱するわけがありません!!



人手不足でやってなかった長期安定性試験の中で、
ちゃんとやってた薬に関しても規格外ですか!!



もう笑うしかない…
レボセチリジンが短いスパンで
チェックされていることは評価できるけど…



いやでもそれ当たり前のことだからな?
基準低くなりすぎて評価ポイントバグっているぞ?
顧客からの評価も正直やばい
これだけ不信を得てしまうと現場からの評価もかなり厳しくなってきていまして…
こんなアンケートも東京都では実施されたようです。
アンケートは3月13~31日、会員3756人を対象に実施。2530人から回答があった(各設問で複数回答あり)。日医工製品への対応については「すべて他社製品に変更した(する予定)」が28%(706人)で、「一部のみ変更」を加えると86%(2202人)だった。
約3割が全切替!&9割り近くが一部変更した!
4/6からは全社一丸となって信頼回復に勤めるはずが、いきなりの再自主回収で出鼻を大きく挫かれた形となりました。



ぶっちゃけ何を信じればいい?
という顧客がほとんどでしょう。
04/21:2製品4製剤が回収(クラスⅢ)
アナストロゾールとイルべサルタンが自主回収になりました。
- アナストロゾール錠1mg「EE」 自主回収に関するお知らせとお願い(クラスⅢ)
- イルベサルタン錠50mg「EE」 自主回収に関するお知らせとお願い(クラスⅢ)
- イルベサルタン錠100mg「EE」 自主回収に関するお知らせとお願い(クラスⅢ)
- イルベサルタン錠200mg「EE」 自主回収に関するお知らせとお願い(クラスⅢ)
理由は
共同開発先の他社製造販売業者が作成した承認申請資料が信頼性の基準に適合していなかったことが判明いたしました。このため、自主的に当該製品の承認 整理を行う予定であることから、使用期限内の全ロットを回収いたします。
引用:イルベサルタン錠50mg「EE」 自主回収に関するお知らせとお願い(クラスⅢ)
承認申請資料に嘘ありました!!ってとんでもないこと書いてあるんですが…
これはアレです!小林化工さんですね!!製造元が小林化工であちらの違反問題の煽りを受けた形ですね。



日医工は被害者ですね!
04/22:164品目に欠品の可能性あり
業務停止命令でラインを止めていた&チェックを行いながら製造を再開している関係で164品目に欠品のリスクが生じました!



お知らせ文書には可能性と記載されていますが、これまでの経緯を考えるに欠品するものとして見たほうが良さそうです。
なお164製品のうち過半数が
4月での在庫消尽となっていました!
※詳細はコチラを確認ください。
(開示事項の経過)当社富山第一工場の製品における一部供給遅延に関するお知らせ
多すぎるので一覧化は許してください…
05/24:アロチノロール塩酸塩錠5mg製剤自主回収



溶出性試験未適合で
自主回収が入ります。
同一の製造所に製造を委託しているアロチノロール塩酸塩錠5mg製剤(後発医薬品)に つきまして、安定性モニタリングにおいて溶出試験の結果が規格に適合しないロットが確認されました。そのため、 使用期限内に規格不適合となる可能性を否定できないロットの製品について自主回収させていただくことと致しました。 含量は規格内であることを確認しており、溶出が遅延することにより吸収に遅れが生じる可能性がありますが、 重大な健康被害につながる恐れはないと考えております。なお、現在まで当該製品を使用しての健康被害の報告は 受けておりません。
コレはあれですね。長生堂さんの違反の巻き込み事故ですね。



詳しくはこちらをチェックしてください!


06/09:オキサトミド&ニカルジピンの回収(長期安定性試験未適合)
今回は2製品3製剤ですね!
回収理由は……
- オキサトミド:長期安定性試験24カ月にて溶出性試験未適合
- ニカルジピン:長期安定性試験36カ月にて溶出性試験未適合
長期安定性試験!
ちゃんとした作り方してないなら長期安定性試験でどんどん弾かれてくるはず
という旨の予想を行なってきましたが、その通りになってますね…残念ながら



他社が関わらない直近の回収は4/8なのですが、この時の回収理由も長期安定性試験未適合でした。つまり直近3ヶ月の回収理由は長期安定性試験未適合
これが氷山の一角なのか、これで終わりですむのか…コレから要チェックです。
08/05:クラリスロマイシンDS10%小児用自主回収
弊社販売の『クラリスロマイシンDS10%小児用「日医工」』(製造販売元:日医工株式会社)に つきまして、
本製品の長期安定性試験(18カ月)において、溶出性試験が承認規格に適合しない結果が 得られたことから、
同様な製造管理のもと製造したロットについて、使用期限内の全ロットを自主回収 いたします。
2ヶ月ぶりの自主回収ですね。
予想通り長期安定性試験がクリアできない製品が続いています。
現状を整理すると
- 人員不足により問題発覚まで長期安定性試験をしっかりやってなかった
- 長期安定性試験違反が続いている
という状況です。
現状、残念ながら日医工の製品の長期安定性を信じることは
非常に困難になっていると言わざるを得ません。



時間が経ってわかるもの…という性質上
だらだらと続きそうですね。
09/29:オルメサルタン、ニチコデ、バラシクロビルの自主回収(クラスⅡ)
| 対象製品 | 内容 |
|---|---|
| オルメサルタンOD錠20mg「日医工」 | 安定性モニタリングにおいて、溶出試験が承認規格外となりましたロットと 同様な製造管理のもと製造しました使用期限内の当該ロット |
| オルメサルタンOD錠40mg「日医工」 | 安定性モニタリングにおいて、溶出試験が承認規格外となりましたロットと 同様な製造管理のもと製造しました使用期限内の当該ロット |
| ニチコデ配合散 | 定量試験が承認規格外となりましたロットと 同様な製造管理のもと製造しました使用期限内の分包包装品の全ロット |
| バラシクロビル顆粒50%「日医工」 | 長期安定性試験並びに安定性モニタリングにおいて、 定量試験及び溶出性試験が承認規格外となりましたロットと 同様な製造管理のもと製造しました使用期限内の全ロット |
今回は見てみてわかるように、
過去規格外となった製品と同様の製造管理を行なった製品
これらを自主回収する…という対応ですね。



国との話し合いの結果なのか、日医工側のリスク管理なのかは不明ですが
新たな違反があったというわけでは無いようですね。
ただよく出そうな薬だから、欠品ダメージはそれなりにありそう…
11/25:エバスチン&テオフェリンの回収(クラスⅡ)
| 対象製品 | 内容 |
|---|---|
| エバスチンOD錠10mg「日医工」 | 安定性モニタリングの結果、純度試験(類縁物質)が使用期限内に不適合になる可能性 |
| テオフィリン徐放錠200mg「日医工」 | 長期安定性モニタリング(12箇月時点)において、溶出性試験の6時間時点で承認規格に適合しない結果が得られました。これを受け、当該ロット及び各キャンペーンの代表となるロットの参考品の溶出性を調査したところ、一部のロットにおいて溶出性が承認規格に適合しない可能性が示唆 |
少しスパンは空いてきた気がしますが、
安全性モニタリング、長期安定性モニタリングが続きそうです…



いつになれば終わるのか…
2022/03/16:5成分6製品の自主回収
もうすぐ2年が経とうとしています…
途中から予測していた通り
安定性モニタリングの規格外が目立ってきました…
| 対象製品 | 内容 |
|---|---|
| アンブロキソール塩酸塩錠15mg「日医工」 | 溶出試験の個々値において規格を下回るものが確認されましたことから、溶出性が承認規格に適合しない可能性が示唆される為 |
| オメプラゾール錠10mg「日医工」 | 溶出試験の個々値において規格を下回るものが確認されましたことから、溶出規格外になる可能性を否定できない為 |
| オメプラゾール錠20mg「日医工」 | 溶出試験の個々値において規格を下回るものが確認されましたことから、溶出規格外になる可能性を否定できない為 |
| オランザピン錠10mg「日医工」 | バラ包装の安定性モニタリングにおいて、純度試験(類縁物質)が承認規格に適合しない結果が得られたロットや、 承認規格に適合していますが使用期限内に不適合になる可能性があるロットが確認されたため |
| オルメサルタンOD錠10mg「日医工」 | 安定性モニタリングにおいて、溶出試験が承認規格外となりましたロットと同様な製造管理のもと製造しまし た使用期限内のロットを自主回収 |
| セチリジン塩酸塩ドライシロップ1.25%「日医工」 | 安定性モニタリングにおいて、定量試験が承認規格に適合しない結果が得られました。 また、含量均一性試験の結果にばらつきが確認され品質に懸念があることから、使用期限内の全てのロットを 自主回収 |
05/13:本事業再生ADR手続
日医工が本事業再生ADR手続を開始しました。
本事業再生ADRとは、過剰債務に悩む企業の問題を解決するための、裁判外紛争解決手続きのひとつ。 会社更生法や民事再生法などの法的手続によらずに、債権者と債務者の合意に基づき、債務の猶予・減免等を行う引用:事業再生ADR
つまりは『債権者さん…なんとか立て直すから…支払い待ってよ!!!』という内容です。
資金が間違いなく焼きつきました。
理由はプレスリリースによると
- 富山第一工場でいまだ一部 の製造予定品目が出荷再開には至っていない
- 日医工連結子会社エルメッドの小林化工製造委託品の販売中止
- 薬価引き下げによる収益構造の悪化
- 北米のバイオシミラー&オーファンドラッグ開発計画見直しによるのれん・無形資産を中心としてた減損損失
まぁ色々書かれてはいますが、本記事で取り上げている品質問題が引き金です。
信頼を失うと日医工のような大きな会社でも傾く…ということを如実に表しています。
都度所管
理由不明だけど馬鹿みたいに多いぞ?と4月の段階で思いましたが、
その時の直感が恐ろしくも当たっている状況です。
正直出口の見えないトンネルの様相を呈してきました。
これだけ長くなると心配なのが第一線で謝罪するMRのみなさんの精神状況です。同業としてどうしても心配になってしまいます。もういいから取引切ってくれ!!と思っているMRさんすらいそうです。
数字が大好きなMRがこれを言い始めたら危険信号です。ご迷惑を被っている消費側の皆様には申し訳ありませんが、こんな人見かけたら優しくしてあげてください…