標的タンパク質分解誘導薬
…聴き慣れない薬ですよね。
でもこれも、これからの創薬を変えるかも?
と言われているモダリティの一つです。
英語の
Targeted Protein Degradationの
頭文字をとって
TPDと呼ばれたりもします。
TPDって実は色々開発されていまして
もっともメジャーなタイプを一言で解説すると
E3ユビキチンリガーゼ (E3) 結合ドメインと
標的タンパク質結合ドメインを
リンカーで繋いだ二機能性の低分子化合物
 チクチク
チクチクこう表現できるのですが、
ぶっちゃけこれじゃあ
訳わかんないですよね!



日本語…
喋れや!!
そこで今回は、
この分かりにくい日本語の薬を
中学3年生でもわかる!をコンセプトに
基本を解説していきます。



基本なので
所々の省略はご容赦ください!



これから製薬業界にいる人は
知っておいた方がいい薬
だと思うわ!
ユビキチン-プロテアソームシステム
TPDを解説する上で避けて通れないのが
ユビキチン-プロテアソームシステムです。
ユビキチン-プロテアソームシステムは
簡単にいうと不要なタンパク質を
選択的に分解するシステムのことです。



なお細胞内で
働くシステムです!
タンパク質の分解を制御することで
細胞周期やアポトーシス、
シグナル伝達から転写制御まで
さまざまな体内の調整を行なっています。
このシステムの発見は
実はノーベル賞受賞発見でして、
- イスラエル工科大学の
アーロン・チェハノバ教授 - 同大学の
アブラム・ヘルシュコ教授、 - カリフォルニア大学アーバイン校の
アーウィン・ローズ博士
この3人は、
2004年ノーベル化学賞を受賞しています。
ユビキチン-プロテアソームシステムで
登場する物質は5つです。
- ユビキチン
- プロテアソーム
- E1:ユビキチン活性化酵素
- E2:ユビキチン結合酵素
- E3:ユビキチンリガーゼ
ユビキチンはubiquitous
(普遍的な、どこにでもある)
+ -in(タンパク質の接尾辞)という名の通り
あらゆる細胞が持っている
小型のタンパク質です。
これがさまざまな形で
タンパク質にくっつく事で
タンパク質の運命が決まります
プロテアソームは
タンパク質分解酵素複合体
と呼ばれるもので、
簡単にいうと
タンパク質のシュレッダーです。
ここでタンパク質はバラバラになります。
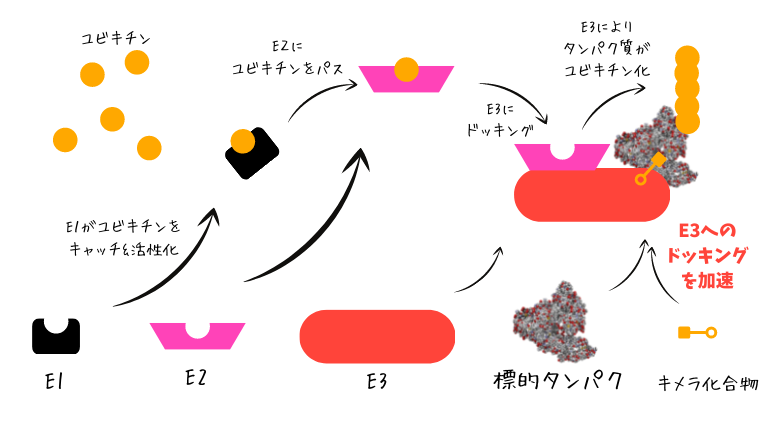
E1、E2、E3の連続反応で
タンパク質はユビキチン化されます。
名前の通り
- 活性化する酵素
E1:ユビキチン活性化酵素 - 結合して運ぶ酵素
E2:ユビキチン結合酵素 - 合成する酵素
E3:ユビキチンリガーゼ
上記3つの酵素がそれぞれ協力して
タンパク質をユビキチン化します。



メカニズムを
簡単な図にしてみました。
次項をご覧ください!
ユビキチン-プロテアソームシステムの
メカニズム
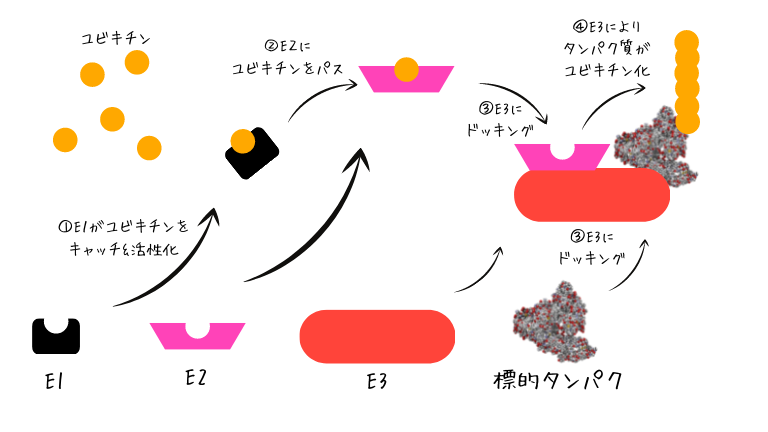

- まず活性化酵素であるE1が
ユビキチンをキャッチし活性化します。
その後E2にユビキチンを渡します。 - 結合酵素であるE2は
ユビキチンと結合した後、
E3と結合し複合体を形成します。 - 結合後E3はE2からユビキチンを受け取り
さらに不要になったタンパク質を認識し
ユビキチン化します。
結合するユビキチンが十分な長さになるまで
この反応は繰り返されます。



このようにタンパク質が
ユビキチン化されます。



タンパク質に
不用品タグをつけるイメージね
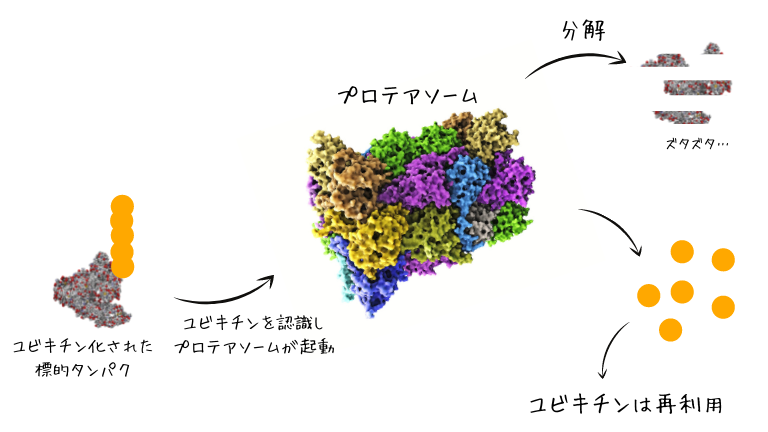




次に不用品タグがついた
タンパク質には分解屋である
プロテアソームが
近づいてきます。
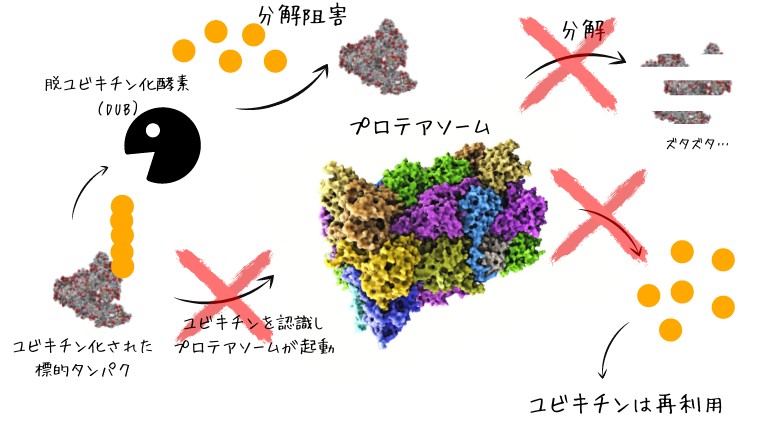
- ユビキチン化された
タンパク質のユビキチン鎖を
プロテアソームが認識します。 - プロテアソームにより
タンパク質はズタズタに分解されます。 - ユビキチンは放出され再利用されます。



ユビキチンによるタグ付けと
プロテアソームによる
分解を行うのが
ユビキチン-プロテアソーム
システム!



ポイントは
直接タンパク質を
ユビキチン化するのは
E3ってことね
標的タンパク質分解誘導薬とは



さてここからは本題のTPD
標的タンパク質分解酵素誘導薬
を紹介します。



その前に確認なんだけど
TPDってどこがすごいの?



簡単にそこも
紹介しときますね!
TPDの利点
そもそも
TPDがなぜもてはやされているか?というと、
これまでの低分子化合物の
弱点を補えるからなんです。
これまでの低分子化合物を使った薬は、
そのほとんどが
体の中で機能するタンパク質を
阻害することで機能します。
その時タンパク質に空いている
穴を足場にして、
結合し機能を阻害します。
そして
結合した結果、機能する場所を塞ぎ
タンパク質の機能を奪います。
つまり
足場となる穴が、機能する場所の側にあって
初めて薬効を発揮します。
でも、わかっているタンパク質の
2割くらいしか足場を持っていない
と言われています。



つまり、
このタンパク質を阻害すれば、
治療薬になりそうなのに
足場がなくて薬が作れない!
こんなのとが
起こっているのね!



これに風穴を開けられそう…
というか
理論上はほぼ全ての
タンパク質に応用できる
のがTPDなんですね!
そして芋蔓式に
複数の薬を作れる
可能性が高いんです。
キメラ化合物
一般にTPDというとこ
のタイプを指すことが多いですね。
かなり研究開発が進んでいるグループです。
冒頭説明した
E3ユビキチンリガーゼ (E3) 結合ドメインと
標的タンパク質結合ドメインを
リンカーで繋いだ二機能性の低分子化合物
という説明はまさにこのタイプです。
PROTACやSNIPERと
名前のついた化合物もすでに登場しています。
両方とも
PROTAC(proteolysis targeting chimera)
SNIPER(specific and nongenetic IAP-dependent protein eraser)
タンパク質分解とか消しゴムとか
なんか消せそうな名前がついています。



ちなみに有名どころだと
ベーリンガー社や
アステラス製薬が
PROTACに参入しています。
関連:ベーリンガーインゲルハイムとダンディー大学、PROTAC創薬プログラムの成功を強調し、抗がん剤の開発に向けた提携を拡張
アステラス製薬がR&Dミーティング の資料を公開しています。今回の内容は『標的タンパク質分解誘導』です。
— チクチク@製薬ブログ (@mrnetinfo) December 10, 2022
資料の中に各社の開発状況をわかりやすく並べたものがありました。浅学なので初めてみたデザインでしたが、素直にわかりやすくていいな…と感動しました😳https://t.co/TSIdWR3YhB pic.twitter.com/ANONGf1CIx
キメラ化合物タイプの構造
基本的な構造概念はカンタンでして
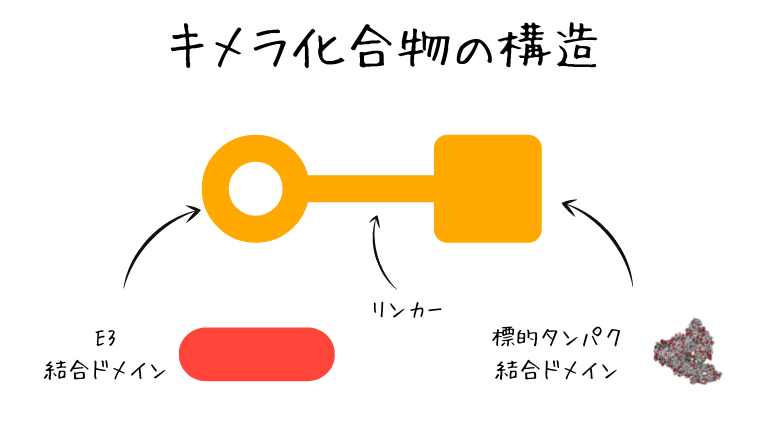

E3と標的とするタンパク質に
結合する力を持っています。
概念としては過去紹介した
二重特異性抗体と同じです。



実際、二重特異性抗体を用いたTPDも研究がされています。
二重特異性抗体を持つ
アムジェン社も
開発を進めている様です
キメラ化合物タイプの作用機序
キメラ化合物タイプの作用機序は
E3とタンパク質をくっつけることで
そのユビキチン化を促進します。
特定のタンパク質だけ
どんどん引っ張ってきて
E3に渡しますので
特定のタンパク質だけが
どんどんユビキチン化されて
プロテアソームで分解されていきます。

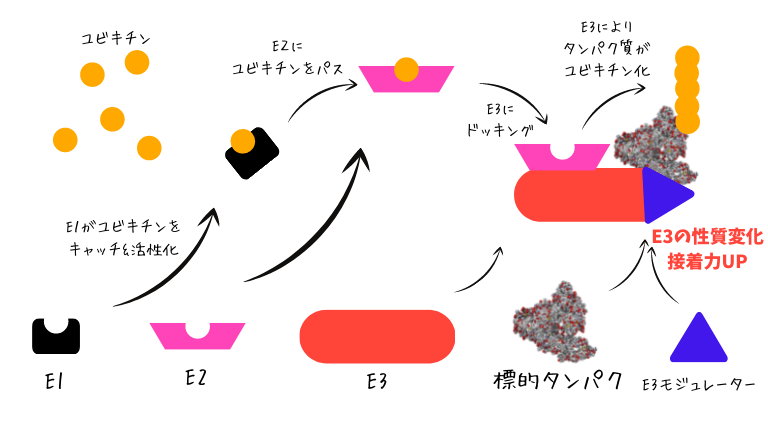
E3モジュレーター
E3自体の機能を変化&調整してしまう
E3モジュレーター
と呼ばれるタイプも存在します。
基本的にはE3と特定の標的タンパクが
くっつきやすくなる様に変化させるため
分子糊とも呼ばれます。
作用機序はE3に直接ドッキングすることで、
機能を変化させます。

実はこのタイプは既に発売されています。
レナリドミド(製品名レブラミド)という
抗悪性腫瘍用剤です。
正確には発売後に
E3モジュレーターの
作用があることがわかりました。
(作用機序の一部であって全てではありません)
ちなみにレナリドミドは
サリドマイドの誘導体です。



セルジーン社の資料に
詳しい作用機序が
記載されていたので
引用します。
レナリドミドはセレブロンへの結合を介して Ikaros 及び Aiolos のユビキ チン化を惹起し、それに続くプロテアソームによるこれらのタンパク質の分解を促進する。Ikaros 及び Aiolos は免疫細胞の発生・分化やホメオスタシスを制御する重要な転写因子であり、レナリド ミドによるこれら因子の分解促進が、T 細胞機能を調節することが知られているインターロイキン 2 (IL-2)及びその他のサイトカインの産生を増強する。したがって、レナリドミドの MM 細胞及び T 細胞に対する薬理作用の作用機序として、Ikaros 及び Aiolos の分解促進とそれによる細胞内濃度 の低下が考えられている。
引用:セルジーン社 レナリドミド 2.4 非臨床試験の概括評価
カンタンに要約すると
レナリドミドは
E3の構成タンパク、セレブロンへ結合し
Ikaros 及び Aiolosという転写因子 の
ユビキチン化を行います。
karos と Aiolos は
免疫細胞の発生・分化、
ホメオスタシスを制御する
重要な転写因子…
かんたんにいうと
免疫系のブレーキなので、
karos と Aiolosを分解すると、
免疫のブレーキが外れ活性化し
サイトカインの産生が加速し
T細胞を活性化します。
結果がん細胞を活性化した
T細胞が攻撃します。
こう書かれています。
つまりレナリドミドはE3に結合することで
karos と Aiolos だけをどんどんユビキチン化して
分解するようにE3を調整したわけです。
余談ですがサリドマイドと比べても
T 細胞に対する活性化作用は強く、
100–1000 倍と言われています



レナリドミドは偶然生まれたE3モジュレーターですが、
レナリドミドに続けと
現在研究が進められています。
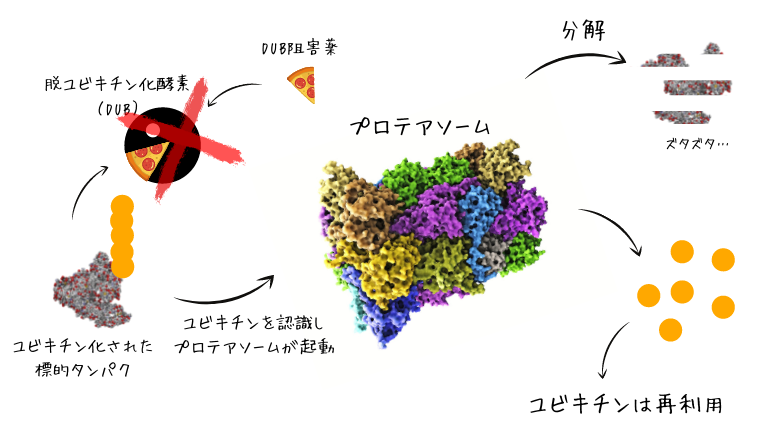
DUB阻害薬
最後がDUB阻害薬です。
ちょっと毛色が違うので入れるか迷いましたが、
抗がん剤として期待されているので
紹介いたします。
DUBはDeubiquitinase…
カンタンにいうと
ユビキチン化を解除する酵素です。

せっかくタンパク質に付与した
ユビキチンが解除されますので
タンパクが分解されず機能しづづけます。
これが活性を異常に失ってしまうと
必要なタンパク質まで
異常に分解されてしまいますし
異常に活性化されてしまうと、
全くタンパク質が
分解されてなくなってしまいます。
特にDUBの高発現や異常な活性化が、
がんや神経疾患などを誘導することが
明らかになっているため
現在はDUBを阻害することで
タンパク質の分解を促進する
DUB阻害薬が開発されています。

あとがき
標的タンパク質分解誘導薬の解説
いかがだったでしょうか?
ユビキチン-プロテアソームシステムを介した
魅力的なテクノロジーですよね!
おそらく近い将来、
臨床の場でもどんどん使われる様になるはずです。
それまでの
繋ぎの内容になれていましたら幸いです。



お本内容はさわりです。
もっと詳しく知りたい方は
書籍をどうぞ!