チクチク
チクチクみなさんこんにちは!
貴方のスマホのお薬妖精です🧚
いきなりですが
あなたがカレー屋だとして、役所にこう言われたらどう思いますか?
「原価情報を80%出さないと、人気メニューの値上げはゼロ。さらに利益率にも上限。」
…たぶん、新メニューは別の街で先に出しますよね。至極当然の対応です。
しかしながら現在、医薬品でも同じことが起きていまして、ドラッグラグ・ロスの一員となっています。
そう今日のテーマは薬価の原価算定方式の時に出てくる原価開示度です!
原価開示度を強く求めすぎる現在の設計は、ドラッグラグ・ロスを加速させかねません。



今回は導入の経緯とその理不尽さを紹介し『なぜ現場には無理ゲーに見えるのか』まで一気に見ていきます。
原価開示率と導入の経緯
今は薬価を抑えるためだけに運用されていると言っても過言ではない原価開示率ですが、元々の始まりはかなりありがたい議論と一緒に始まっています!
元々は
革新的新薬が多い原価計算方式の薬価決定ってイノベーション評価が十分じゃないよね!
こんな課題から始まっています!
原価計算方式が採用される医薬品は、革新的な医薬品も含まれ得るにもかかわらず、そのイノベーションに関する評価は、類似薬効比較方式と比較して、薬価全体に対して限定的。
引用:厚生労働省保険局医療課 平成30年度 薬価制度の抜本改革の概要



そこで営業利益にのみ行っていた加算を価格全体に拡大することで加算額を大きくしよう!
という非常にありがたい変更が行われました!
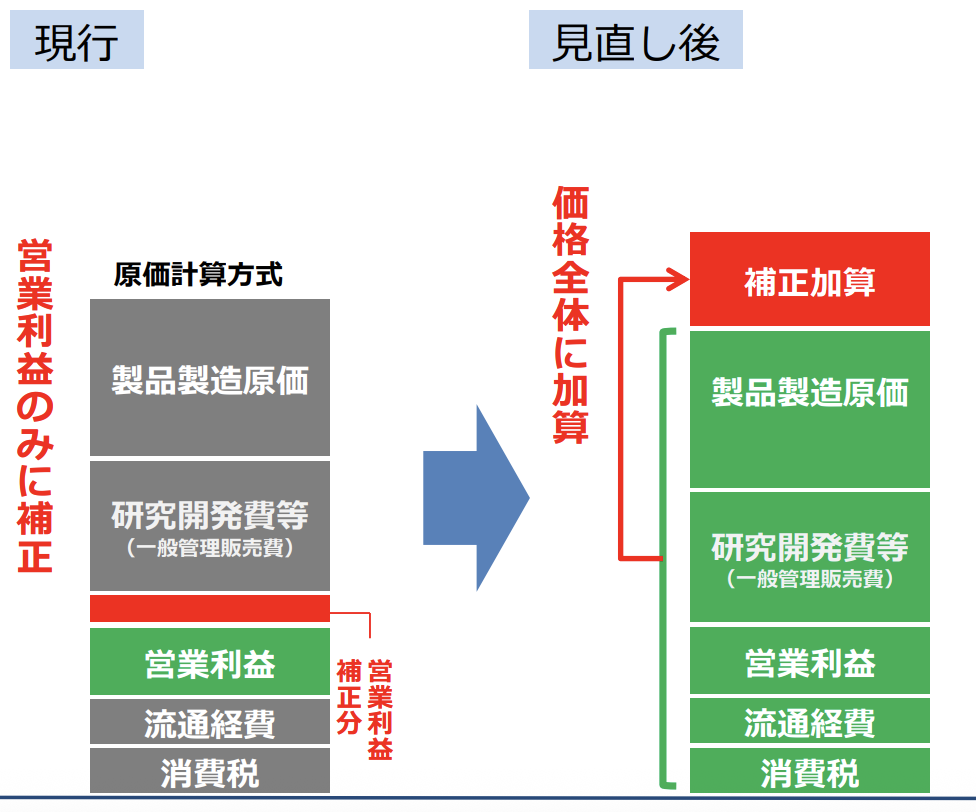

厚生労働省保険局医療課 平成30年度 薬価制度の抜本改革の概要より



この時に同時に製薬会社に要求してきたのが
「開示率」です!
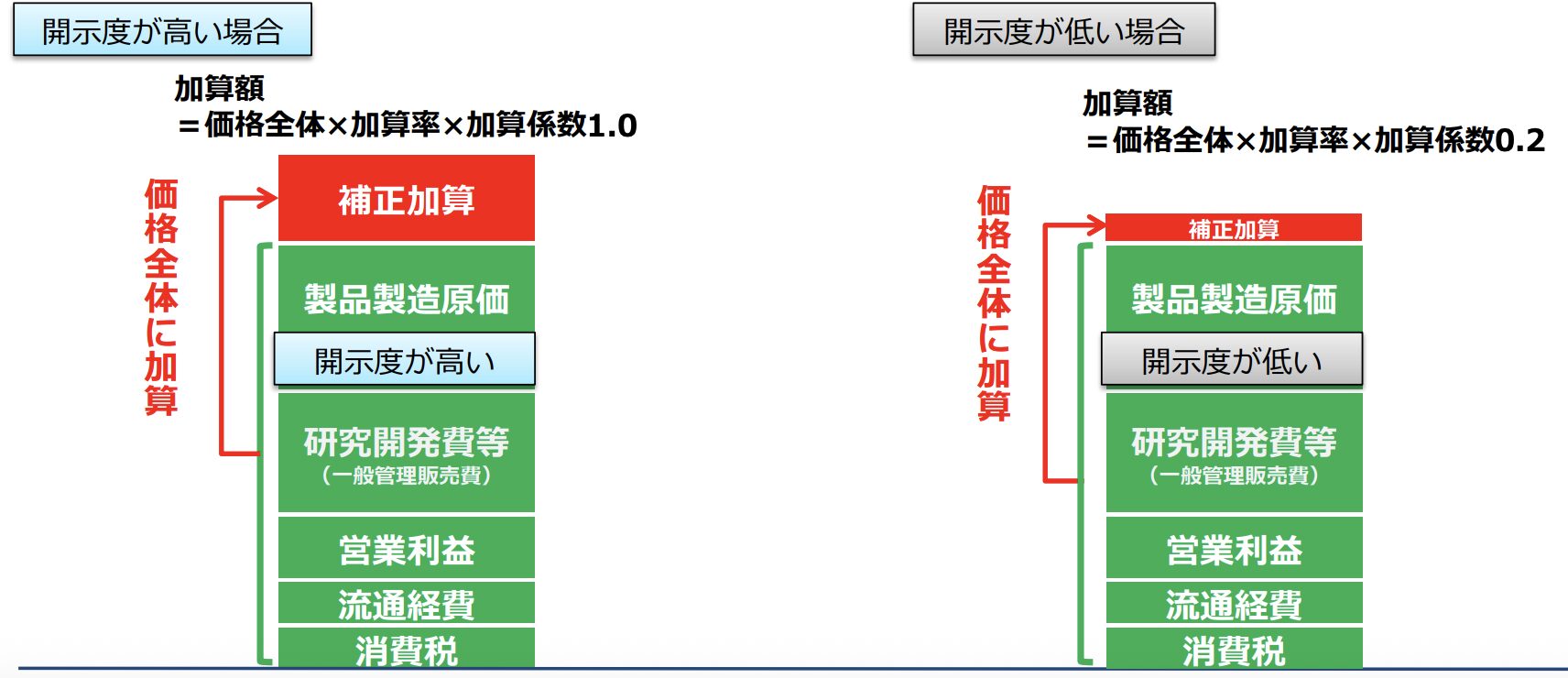

厚生労働省保険局医療課 平成30年度 薬価制度の抜本改革の概要より
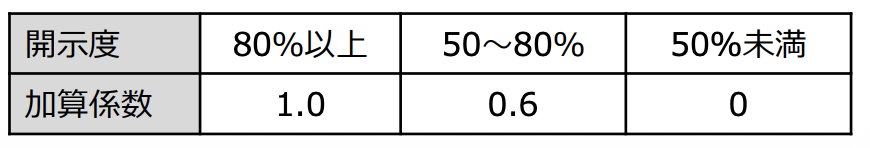
薬価算定の透明性を向上させる観点から、原価計算方式において、製品総原価のうち、薬価算定組織
での開示が可能な部分の割合(開示度)に応じて、加算率に差を設ける。
引用:厚生労働省保険局医療課 平成30年度 薬価制度の抜本改革の概要
要は最初は透明性を求める観点から
沢山開示しているところには沢山加算つけるよ!
こんな建て付けだったんです!
そして当初の区分はこんな感じ!
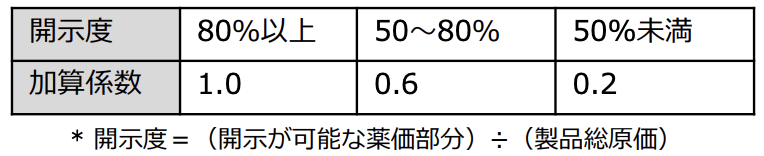

厚生労働省保険局医療課 平成30年度 薬価制度の抜本改革の概要より
ポイントは開示されていなくとも0.2の係数なので、
増えた加算の0.2倍…と
結果としては
開示率が低くとも従来の加算とは大きく変わらず
開示率が高ければ5倍の加算を取れる…という


透明性が高いならイノベーションをより評価するよ!



こんな意味合いの、ありがたく&納得性の高い制度としてスタートしました!



イノベーションをより評価する制度にバージョンアップしたわけね!
しかしながら2021年12月22日
大きく流れが変わります!
現在の加算係数の設定において必ずしも開示が進んでいないことから、開示度50%未満の場合の加算係数を現在の0.2から0に引き下げる



0?え??
そう!開示率が低い場合はイノベーションを評価しない制度に魔改造されてしまします…
当然、反発もありまして、経団連の眞田享委員は
本件につきましては、これまでも企業側にもやむを得ない事情がある場合も想定されるのではないかという点を指摘させていただき、先日の業界ヒアリングでもイノベーション評価の観点から非常に厳しいという声があったところでございます。もちろん透明性の視点は重要であり、開示度の向上を図る点に全く異論はございませんけれども、一方で、イノベーション評価の観点から加算部分が全く薬価に反映されないという取扱いの影響が大変気になるところでもあります。今回の見直しが開示度向上だけではなくイノベーションの評価という観点から新薬の開発、上市に影響がないか、今後、算定状況などについて確認をしていくべき
と反対を表明しています。
まぁこんな意見は華麗にスルーされ問答無用で2022年4月より改悪を受けます!

たった一つの改訂ポイントですが
0という数字に変わったおかげで、
透明性が高いならイノベーションをより評価するよ!
という制度から
透明性が高いならイノベーションを評価するよ!
低いならイノベーション評価を取り上げるよ!
という制度に暗黒進化を遂げました…
本来はイノベーションを評価するための制度として始まったはずが、あくまで開示率を上げるための制度に変更されてしまったのです…目的が大きく変わっています。
そして我らがヘルジャパン
さらに追い討ちを行います…
開示50%未満の品目は、営業利益が費用対効果評価における価格調整の対象になります。
加算ゼロだけでなく、利益そのものも圧縮されます。
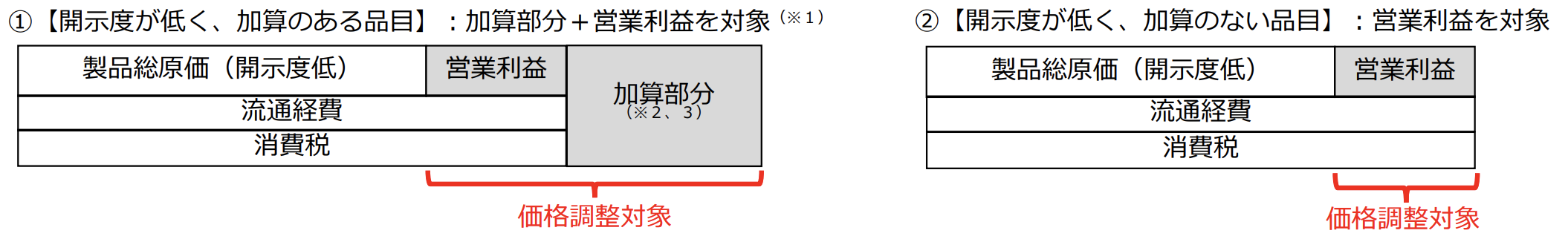

ざっくりいうとよく売れる医薬品で開示率が低いものは加算がもらえないだけでなく、営業利益を減額されるようになりました…
イノベーションを評価するという理念から始まったはずが、イノベーションを起こしたヒット医薬品の利益を奪う制度に進化します。



いや…真の目的はこっちだったのでしょう。革新的新薬に加算を与えず、利益も奪いできるだけ安く日本に供給させる薬価システム



遅効性の毒饅頭を食わされたワケね


なぜ「開示80%」はエベレスト級に難しいのか
ここまで聞いていて思った人も多いと思います。
開示率80%を目指せば良いんじゃない?



でもこれ簡単じゃないんです。経団連の眞田享委員もやむを得ない場合があると言ってますよね?



今回はなぜ難しいのか…
よく言われる問題を3つ紹介します!
- 企業秘密と機密保持の問題
- サプライチェーンの問題
- 移転価格とLRDの問題



順番に見ていきましょう!
企業秘密&機密保持の問題
まずはじめに企業秘密と機密保持の問題です。
至極当然ですが、深い明細を出すほど情報漏洩リスクは上がります。
薬の原価情報が漏れると、調達先や単価からサプライチェーンが特定され、利益率や価格戦略が推測されます。
その結果、競合による価格攻勢、サプライヤーや販売先との交渉力低下、他国薬価への悪影響など、企業競争力を損なう重大なリスクが生じます。
こんな無視できないリスクがありますので、原薬メーカーなどの製造関連他社が機密保持の観点から開示に合意してもらえず、知っているのにオープンにできないことが多々あります。



本来原価情報は競争力の根幹なのよね…
それをオープンにする命令がどれほど横暴か…
さらに、深い明細があると海外の費用対効果評価や当局との価格交渉で使われる可能性が上がります。
つまり「日本でそう言うなら、うちも下げて」と値下げ圧力がかかりやすくなる。日本での“善意の透明化”が、海外交渉で不利なカードになることがあるわけです。



実際米国も最恵国価格に合わせるといってきていますよね?





薬は一社で作る時代ではないんです…
サプライチェーンの問題
薬は一社で作る時代ではないと述べました通り、薬は多国籍サプライチェーンで作られます。
たとえば原薬はインド、充填はドイツ、包装はシンガポール。この状況で当局に証憑を出すわけですが、規格に合わせて数字を積み立てる必要があります。
原材料費(有効成分、賦形剤、容器、箱など)は当該品目に係る実費用が個別に積算可能
箱とかパッケージング違うから当然なのですが、規格ごとに数字出すんですよね。
たとえば同じ薬でも 「50mg錠×28錠PTP」 と 「50mg錠×100錠ボトル」 は別として計算され。PTPやボトルでは包装材費・検査工程・ラベル・添付文書・輸送条件・廃棄率まで変わります。
何が言いたいかというと
原価表も別に作らなきゃいけないってことです!
国や工場ごとにバラバラに発生した証憑を「日本向け・製品規格に関係する分だけ」切り出して積立合算する
――こんな作業をしなければなりません。国や工場ごとにバラバラに発生した証憑を、「どの国のどの工場で、いつ、どの工程にかかった費用か」まで分け直し、日本向け規格に紐づく分だけを拾い上げて合算します。



イメージは、レシートの束(国×工場×月×工程)から、日本で売る50錠ボトルだけのレシートを選び出して家計簿に打ち直す感じ。コストと手間がかかりますよね?



そしてそれを管理して監査する手間も発生します。雪だるま式にやることが増えていくとはまさにこのこと…ほんと無理ゲー
移転価格とLRDの問題
次のハードルは
移転価格とLRD



LRD???



ざっくり解説するとこんな感じです
欧米の医薬品企業が日本の医療用医薬品市場におけるインバウンド企業として活動する際には、国外で開 発した製品を提供する、リスク限定型の販売会社(Limited Risk Distributor、以下、LRD)として活動するこ とが一般的です。
LRDの場合、手元にあるのは
転売価格(本社からの仕入れ値)だけ…
つまり原価の深掘りに必要な部材・工程ごとの原価表や原料→製品の変換効率といった詳細は本社にあって、日本側には権限もデータもないのが普通です。
イメージで言うと、本社の工場が日本子会社に



この薬、1箱8,000円で仕入れて1万円で売ってね(粗利20%ね)



アイアイサー!!!
こんな状態。
日本側は8,000円の内訳(元薬が何円、溶媒が何円、検査が何円、歩留まり何%…)を見られない&触れない。
だから「出したくない」以前に、日本だけでは出しようがない。深い原価を作るには本社の開示と協力が前提になる、というわけです。



そして前述の通り出してもらうのは、めんどくさい&競合優位性を保つための機密情報です。効率重視のグローバル本社がそんなことするのでしょうか笑
小括
結局のところ、問題の本質は「数字を持っていない」わけじゃないんです。「数字を渡すと、別のコストとリスクが一斉に跳ね上がる」こと。
データの再構成したり、
本社連携したり、
会計&監査対応したり、
企業秘密&機密保持対応したり
本社、技術、会計、戦略と全社を巻き込んだ一大プロジェクトになるわけです。



グローバル企業で誰がそんな調整を日本だけのためにするの?って話



だから、“開示80%”はエベレスト級なのよ
現場が取る“合理的選択”が、そのままドラッグラグ・ロスに
ここまでの話で、開示率80%がいかにハードルが高いかは分かってもらえたと思います。
では、製薬企業がその条件を満たせないとき、実際にどう動くのでしょうか。



考えられる現場の選択はシンプルです。
そのままドラッグラグ・ロスにつながってしまいます。
「類似薬効比較方式」でいける領域を優先
まず類似薬効比較方式での薬価収載を狙うようになります。
薬価の決め方には大きく分けて原価計算方式と類似薬効比較方式があります。
類似薬効比較方式は、すでに似た薬があるときに、その価格を基準に新しい薬の薬価を決める方法です。この場合、原価の細かい内訳を出す必要はほとんどありません。
そのため企業は、従来薬がある領域の新薬から先に出すのが合理的な判断になります。
逆に、画期的新薬のように比較する従来薬がない領域は、原価開示の壁を避けられないので後回しになってしまうのです。



画期的新薬が日本に入って来にくくなる…
これがドラッグロス
欧米で先に売って投資回収、日本は後回し
次に売る順番が後回しにされます。
世界にはいくつも大きな医薬品市場があります。2025年現在、日本の市場は全体の4.5%ほどしかありません。
米国や欧州は日本より規模が大きく、かつ価格交渉のルールも異なります。「開示率80%」の条件がない場合がほとんどです。というか私の知る限り原価を求めてくる先進国は存在しないはずです。



原価を求めてくる先進国をご存知の方いらっしゃいましたらXでこっそり教えてください🙇♀️
価格も海外の方が高く設定できることが多いです。
そのため企業は、まず欧米市場で販売して開発費を回収し、そのあと日本に持ってくるという戦略をとります。結果、日本の患者さんが薬を手にするのは数年遅れになるのです。



これがドラッグラグか…
希少疾患・小児は採算割れでスキップも
希少疾患や小児向けの薬は、市場が小さい分、売上も限られます。そして希少疾病こそ、従来の比較薬が少なく、原価算定が多い領域です。
そんな革新的新薬比率が多い希少疾病であっても、原価開示度が50%未満だと薬価への上乗せ加算がゼロになり、採算がほぼ取れなくなる可能性が増えます。
結果、「日本で発売しても赤字になる」という判断になり、最初から日本市場をスキップする戦略も当然考えられます。



製薬会社も利益追求会社ですからね…赤字じゃ売れないよね。これもドラッグラグですね
では、どうすべきか(私見)
では、どうすれば透明性の向上という正義がドラッグ・ラグを生まない制度になるのでしょうか。
簡単に私見を述べさせてください。
カレー屋の例で言えば、「80%のレシピ開示」を求めるのではなく、本当に価格形成に必要な部分だけを共有し、残りは企業のノウハウとして守る仕組みに変えることです。
具体的には――
- 原価開示の範囲を合理化する
- 材料費や製造工程など、薬価算定に直接関係する部分だけに絞る。
- 間接費や企業秘密に直結する部分は、第三者機関での確認のみにとどめる。
- 段階的な開示制度
- 上市から一定期間は、開示率を低めに設定。(例:30%)
- 製品の投資回収が進むにつれ、段階的に開示率を引き上げる。
- 希少疾病薬・画期的新薬への特例
- 海外同時申請や先行承認を条件に、開示率や利益率上限の規制を緩和する。
- 対象範囲は小児、希少疾患、未充足ニーズの高い領域に限定。
- 第三者評価の導入
- 国・企業の直接交渉ではなく、独立した評価機関が原価データを検証し薬価に反映する。
- これにより、企業は機密保持と透明性の両立が可能に。
これらをうまく組み合わせれば、機密を守りつつ、開示をすすめ、さらにラグロスを防ぐ一助となるのではないでしょうか?特に3については昨今の希少疾病推しから希少疾病では早期に実現するのでは?となんとなく考えています。



「全部見せろ」ではなく「必要なところだけ見せてもらう」。
そのバランスを取る制度設計こそが、日本の患者さんに最新治療を早く届けるための鍵になるのではないでしょうか?



4も製薬協の会議資料に議論テーマとして上がっていたことがあるわよね!
まとめ
原価開示度80%を満たさないと補正加算がゼロ、さらに費用対効果評価で営業利益も圧縮
本来“イノベーションを評価”するはずの薬価制度が、後出しの改訂により「開示しない=評価しない」仕組みに改悪されました。
結果、企業は原価計算方式を避け、類似薬効比較方式でいける領域を優先、先に欧米で回収して日本は後回し、希少疾患・小児は採算割れでスキップ——という合理的選択へと企業を導きドラッグラグ・ロスを拡大する可能性に繋がっています。
しかも「80%開示」という高いバーは
- 企業秘密・機密保持
- 多国籍サプライチェーンでの証憑再構成
- 移転価格とLRD構造
という条件により、コストとリスクが跳ね上がるため現実的に高難度。透明性の名の下に原価の深掘りを強制すると、国際価格交渉にも不利が波及し、革新的新薬ほど日本に入りにくくなる。
…こんな内容を紹介して来ました!



無理ゲーよね…詰んでる



国際商習慣に逆行する蛮行と言っても過言ではないと思う!それか革新的新薬を不当に安く使うため狙ってやっているとしか思えない…
一刻も早く、原価率を参照することを我が国が辞めることを願って、今後も中医協をウォッチングしていきたいと思います!



面白かったら是非、拡散お願いします🙇